Репликация цитоплазматическая
1. Вирус проникает в клетки хозяина.
2. Раздевания, и высвобождение вирусного генома РНК в цитоплазму.
3. Вирусная РНК транслируется для производства двух белков, необходимых для РНК-синтеза (репликации и транскрипции). Первой синтезируется ORF 1 до стоп-кодона (геликаза и метилтрансфераза). Дальше происходит синтез ORF2 в результате супрессии стоп-кодона (геликаза, метилтрансфераза и полимераза). Дальше белки ORF 1 andORF2 объединяются и начинается синтез субгеномных РНК.
4. Репликация происходит в цитоплазматических вирусных фабриках. dsRNA геном синтезируется из ssRNA(+) генома.
5. dsRNA геном транскрибируется/реплицируется, тем самым обеспечивая вирусные мРНК/новые ssRNA(+) геномы.
6. RdRp признает внутренние субгеномные промоутеры на отрицательной смысловой РНК для транскрибирования 3’котерминальной субгеномной РНК, которая формирует капсид белков, механизм белка и вирусный супрессор РНК «глушителей».
7. Вирусная сборка в цитоплазме. Каждый сегмент (если мультипартитный) является некапсидным.
8. Вирусный механизм белка, вероятно, является медиатором передачи вириона от одной клетки к другой.
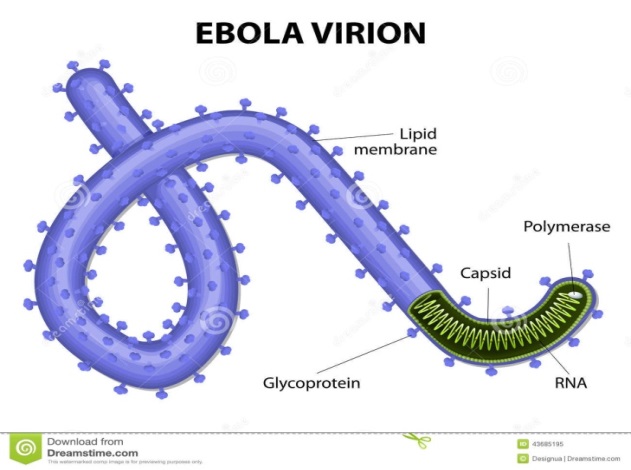
Пример: Filoviridae, (-)одРНК: Ebolavirus (ZEBOV), Marbyrgvirus(MARV)
Ø L=1400нм,
Ø r=25нм
Ø Шаг спирали 5нм
Ø NP – основной белок нуклеокапсида, VP30 – минорный белок нуклеокапсида, 5 структурных белков заякорены во внешней мембране
 Вирусный β-баррель
Вирусный β-баррель
Широко распространенные формы супервторичных структур: β-бочонок (β-баррель).
|
|
|
Основной фолд капсидных белков.
Ø Структурное сходство капсидных белков вируса различной организации (археи, растения, насекомые, позвоночные).
Ø N-концы (а иногда С-концы) капсидных белков как правило сильно заряжены (взаимодействие с нуклеиновыми кислотами и/или участие в квазиэквивалентном взаимодействии).
В настоящее время известна пространственная структура более 50 капсидных белков различных вирусов. Большинство из них представляют характерный тип архитектуры (фолд), известный как «вирусный бета-баррель», содержащий восемь антипараллельных бета-тяжей со специфической топологией их соединения.
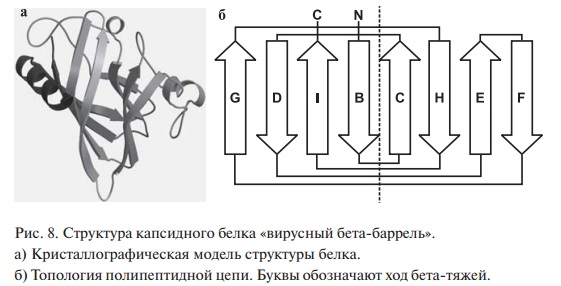
Вирусы, которые построены из белка с таким фолдом, включают вирусы растений (TBSV, TYMV и другие), животных (SV40, риновирус, полиовирус и другие) и бактерий (бактериофаг φX174). Кроме того, обнаружено, что главный белок оболочки P3 бактериофага PRD1 E. coli, молекула которого содержит два 8-антипараллельных бета-барреля, структурно сходен с белком гексона аденовируса.
Другие фолды капсидных белков
Ø VP3 (внутренний капсид ВТV) – 103 кДа, 901 а/к.
Ø Преобладают структуры из α-спиралей (кроме фага MS2). Несмотря на то, что капсидные белки BTV и L-A формируют вирионы похожей формы с Т=2(1) они не имеют структурной гомологии.
|
|
|
Фолды вирусных фибрилл
Ø Фибриллы образованны протяженными в петлях Д-Е, F-G («неканонические инфекции»).
Ø Двойной β-баррель способствует укладке белков, формирующих фибриллы вириона, и капсидных белков вируса, у кт гексоны сформированы триммером (BTV, Ad)
β -Структура (рис. 3.17). Здесь остовы пептидных цепей не скручены в спираль, а имеют зигзагообразную конфигурацию (структура складчатого листа).
Такая структура тоже удерживается водородными связями и между теми же группами (—NH— и —СО—). Но теперь (если речь идет о глобулярномбелке) для сближения этих групп и образования связей пептидная цепь образует складки.
Т. е. имеется двойная складчатость:
Ø во-первых, крупные складки в результате поворота цепи на 180°,
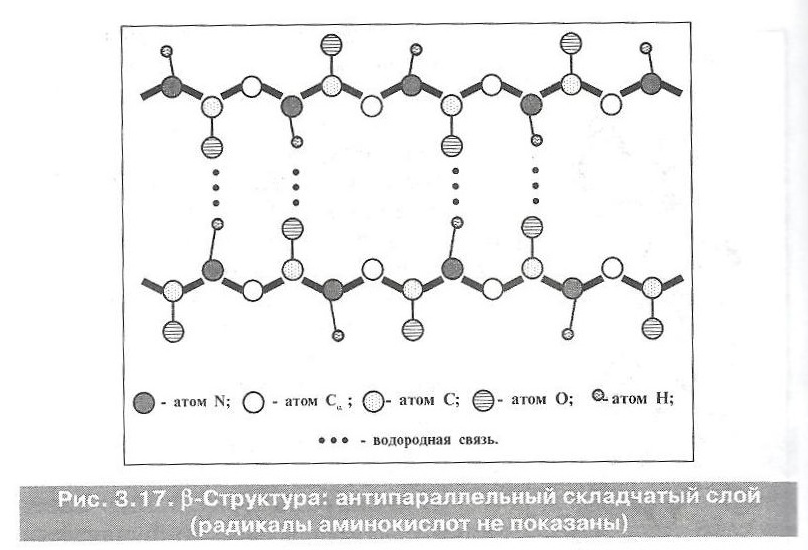
Ø во-вторых, мелкие изгибы цепи в пределах одной складки.
Прилежащие друг к другу участки цепи в β-структуре могут быть как параллельными (идти в одном направлении), так и антипараллельными.
В фибриллярных белкахс β-структурой в образовании водородных связей участвуют соседниеи расположенные параллельно пептидные цепи.
9. Капсиды вирусов с (-)РНК-геномом. Организация капсидов Филовирусов, Рабдовирусов, Орто- и Парамиксовирусов.
Дата добавления: 2018-06-01; просмотров: 843; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
