Семейство Inoviridae (нитчатые фаги)
Ø Нитчатые бактериофаги с одноцепочечным ДНК-геномом (оцДНК) входят в семейство Inoviridae (фаги М13, fl и fd, поражающие бактерии E.coli, имеющие F-пили).
Ø Интересной особенностью жизненного цикла нитчатых фагов является способность продуцировать потомство без лизиса клетки-хозяина. Несмотря на это, на газоне бактерий, чувствительных к таким фагам, образуются бляшко-подобные зоны, т.к. инфицированные клетки медленнее растут.
Ø Капсид нитчатых бактериофагов имеет спиральный тип симметрии.

Рисунок 4. Схема строения капсида нитчатых фагов
Положительно заряженный С-конец этого белка взаимодействует с отрицательно заряженной ДНК фага. Диаметр капсида составляет 7 нм, а длина колеблется от 700 до 2000 нм. Такие соотношения размеров обуславливают очень характерный вид этих фагов при съёмке в электронном микроскопе, что в свою очередь дало наименование «нитчатые» этой группе бактериальных вирусов. Концы капсида гетерогенны по составу белков.
Ø Геном нитчатых фагов представлен кольцевой одноцепочечной ДНК, в капсиде находящейся в сверхспирализованном состоянии.
Ø Длина генома Иновирусов колеблется от 4,5 до 8 тысяч нуклеотидов.
Адсорбция нитчатого фага на клетке начинается с взаимодействия домена N2 вирусного белка с концом F-пили бактерии. Пиля втягивается, перенося вирион в периплазматическое пространство бактериальной мембраны. Для дальнейшего проникновения фага в цитоплазму необходимо взаимодействие домена с бактериальным белком. Далее белок осуществляет деполимеризацию капсидных белков и перенос ДНК фага в цитоплазму.
|
|
|
Ø Геномная оцДНК Иновирусов имеет (+)-полярность, т.е. является кодирующей.
Соответственно, для начала процесса транскрипции необходима матричная цепь, имеющая (-)-полярность. Поэтому первым этапом жизненного цикла нитчатого фага в клетке является достройка оцДНК до двухцепочечной формы. Этот процесс осуществляется ферментами клетки-хозяина: РНК-полимеразой, синтезирующей затравку для инициации репликации, и ДНК-полимеразой III, синтезирующей (-)-цепь на (+)-матрице. Полученная фаговая дцДНК (называемая репликативной формой, РФ) готова к транскрипции, которую осуществляет РНК-полимераза бактерии сразу с нескольких промотеров.
Ø Геном фага М13 (типичного представителя Иновирусов) кодирует 11 белков.

Гены (обозначаемые как правило римскими цифрами) сгруппированы по функциям: II, V и X кодируют белки, участвующие в репликации ДНК; III, VI, VII,VIII и IX кодируют белки капсида; I и IV кодируют белки, участвующие в сборке вирионов.
Помимо генов в ДНК нитчатых фагов присутствуют межгенные участки. Большой межгенный участок ДНК фага М13 размером в 507 нуклеотидов содержит ori (точки начала репликации) для (+) и (-) цепей, сильный р-зависимый транскрипционный терминатор и 78-нуклеотидную шпильку, являющуюся паковочным сигналом при сборке дочерних фаговых частиц.
|
|
|
Транскрипция нитчатых бактериофагов довольно сложно регулируется. Два сильных транскрипционных терминатора делят геном на 2 транскрипционных региона: 1)регион [ген II - ген VIII] с высоким уровнем транскрипции, и 2) регион [ген III – ген IV] с пониженным уровнем транскрипции. Внутри регионов также есть градиент по уровню транскрипции, в частности, наибольшее количество мРНК нарабатывается с гена VIII. мРНК гена I напротив нарабатывается в небольших количествах за счёт слабого терминатора в конце этого гена. Сложная регуляция экспрессии генома необходима нитчатым бактериофагам для строгого контроля количества молекул фаговых белков, что в свою очередь способствует максимально эффективному использованию ресурсов клетки.
После накопления некоторого количества фаговых белков начинается репликация ДНК бактериофага по механизму «катящегося кольца» (другие названия: сигма-схема (σ-), схема «разматывающегося рулона»). Этот широко используемый самыми разными вирусами механизм репликации необходим для быстрого накопления дочерних молекул ДНК.
|
|
|
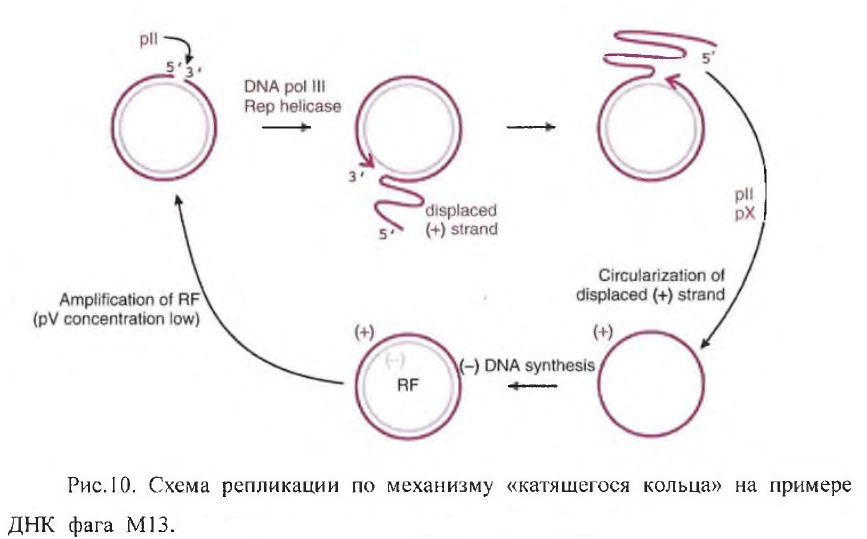
Для начала этого типа репликации необходим «надрез» (+)-цепи дцДНК специфической эндонуклеазой в районе ori. Образованный при этом свободный 3’-конец используется для наращивания (+)-цепи ДНК-полимеразой III бактерии-хозяина, в качестве матрицы для синтеза используется закольцованная (-)-цепь. При этом при движении по кольцевой матрице ДНК-полимераза выталкивает другой конец (+)-цепи. Белок нарезает выталкиваемую ДНК на отдельные молекулы, соответствующие геному фага, и замыкает их в кольцо. В результате образуются геномные оцДНК, чья дальнейшая судьба может быть различна. После первых циклов репликации эти оцДНК достраиваются до двухцепочечной формы (РФ) и включаются обратно в репликативный цикл либо используются для транскрипции. Этот процесс продолжается до накопления в клетке достаточного количества белка. Данный белок связывается с оцДНК фага (свободной от g5p остаётся только паковочная шпилька) и преобразует её из кольцевой в палочковидную форму, после чего такие геномные молекулы транспортируются к бактериальной мембране для формирования вирионов.
|
|
|
Белок фага М13 формирует во внешней мембране бактерии пору, а также связывается с двумя другими вирусными белками, заякоренными во внутренней мембране. Вместе эти белки образуют канал, через который выходит вирион. Дочерние фаговые частицы выходят из бактериальной клетки, не разрушая её.

Рисунок 5. Общая схема жизненного цикла бактериофага М13
11.Сборка фага Т4. Особенности, основные этапы сборки.
Ø Продукты 24 генов участвуют в сборке икосаэдрической головки, 22 - в сборке хвоста, 6 - формируют хвостовые фибриллы.
Ø Около 10 генов кодируют каталитические и шапероноподобные белки, участвующие в сворачивании полипептидных цепей и сборке фаговой частицы.
Сборка головки, хвоста и длинных фибрилл осуществляется независимо друг от друга с последующим их объединением в зрелый вирион.

Сборка головки фага Т4 начинается с формирования на мембране инициаторного комплекса - белка, к которому присоединяются 12 молекул.
Далее на основе этого комплекса формируется ядро прокапсида, состоящее также из белков. Поверхность ядра покрывается слоем белков, что завершает формирование прокапсида.
После этого происходит активация сериновой просиназы, расщепляющей белки ядра на короткие пептиды и осуществляющей ограниченный протеолиз белков. При этом процессе происходит увеличение внутреннего объёма капсида на -50%, а сам капсид отсоединяется от мембраны.
Белок gp20 портальную вершину, обеспечивающую упаковку ДНК и последующее присоединение хвоста.
Завершает формирование головки связывание с поверхностью белков, повышающих стабильность капсида.
В сформированный капсид пакуется геномная дцДНК, полученная в результате репликации. В процессе паковки основную роль играет терминазный комплекс, состоящий из двух субъединиц: большой – и малой.
Терминазный комплекс выполняет функции энергозависимого проталкивания ДНК через портальную вершину и нарезания длинной конкатемерпой молекулы на отдельные геномы. Большая субъединица обладает ДНК-транслоцирующей и АТФазной активностями, а малая субъединица участвует в узнавании ДНК. В отличие от ДНК фага λ в геноме фага Т4 нет специфических последовательностей для нарезания конкатсмсра.
В случае бактериофага Т4 разрезание ДНК происходит по механизму «head-full»: после заполнения геномом головки на портальную вершину передаётся механический стресс, сигнализирующий о необходимости нарезки. В силу неспецифичности такого механизма место разреза ДНК может варьировать в значительных пределах. По этой причине у фага Т4 на обоих концах генома имеются длинные некодирующие концевые повторы (~1600 п.п.), что исключает вероятность разреза по смысловой последовательности.
Базальная пластинка, на основе которой формируется хвост фага Т4, -наиболее сложный структурный комплекс вириона. Она содержит ~150 полипептидных цепей, кодируемых 16 генами, и построена из 6 идентичных
клиньев, окружающих центральную втулку. К базальной пластинке присоединяются короткие фибриллы, а также белки, инициирующие формирование хвостового стержня (канала для ввода ДПК в клетку) из 138 копий белка.
Стержень, в свою очередь, является матрицей для сборки 138 молекул белка в сократимый чехол. И стержень, и чехол обладают спиральной симметрией.
Таким образом, вирионы бактериофагов порядка Caudovirales объединяют в себе структуры, обладающие двумя основными типами симметрии, встречающимися у вирусных капсидов: икосаэдрической и спиральной. Стоит также отметить, что процесс сокращения чехла, происходящий при вводе генома фага в клетку – процесс необратимый.
Ø Длина чехла после сокращения уменьшается с 98 до 36 нм, а диаметр увеличивается с 21 до 27 нм.
Ø Важным компонентом базальной пластинки является комплекс белков, один из которых обладает лизоцимным доменом, разрушающим пептидогликановый слой в периплазматическом пространстве бактерии, и необходим фагу для успешной инъекции ДНК внутрь цитоплазмы.Завершает сборку хвоста присоединение 6 молекул фибритина, формирующих «воротничок» и нити «бакенбард».
Ø Белок фибритин является молекулярным сенсором, реагирующим на изменения условий окружающей среды. При условиях, неблагоприятных для роста фага (например, при низкой температуре), фибритин удерживает длинные фибриллы в фиксированном положении, поднятом вверх вдоль хвоста к капсиду, не давая фагу заразить бактерию.
После упаковки ДНК в капсид и соединения головки с хвостом к вириону присоединяются длинные фибриллы.
Детальные исследования строения структурных белков бактериофага Т4 и последовательности их сборки в зрелый инфекционный вирион позволило создать подробную модель процессов, происходящих при заражении фагами бактериальных клеток. Помимо этого, анализ принципов регуляции сборки фага Т4 помог прояснить многие аспекты механизмов функционирования клетки: формирования цитоскелета, транспорта белков, сборки мультикомпонентных белковых комплексов.
12.Механизмы проникновения вирусов в клетку. Фузия, эндоцитоз (клатрин-зависимый/кавеолин-зависимый), проникновение с образованием поры.
Чтобы инфицировать клетку, вирус первоначально осуществляет поиск чувствительной клетки-мишени, прикрепляется к её поверхности и через многоступенчатый путь внедряется в неё. На этом пути вирус проходит её наружную плазматическую мембрану, освобождается от своей белковой (у икосаэдрических вирусов) или липидобелковой (у оболочечных вирусов) оболочки (процесс «раздевания») и транспортирует свой генетический аппарат (ДНК или РНК) к определённому клеточному компартменту — сайту репликации вирусного генома. На каждом этапе этого маршрута вирус использует тот или иной клеточный механизм и специфическим для вируса способом интегрируется в него для выполнения своей программы внедрения в клетку и инициации инфекции.
Первый этап взаимодействия вируса с клеткой—это адсорбция вируса на поверхности клеток.
Вирусы распознают определённые структуры на клеточной поверхности и специфически прикрепляются к ним посредством своих специализированных рецепторных белков, расположенных на поверхности вирионов.
Спектр клеточных структур, которые используются вирусами для адсорбции, довольно разнообразен и включает белки, углеводные структуры и гликолипиды. Эти структуры очень часто выполняют акцепторную функцию для физиологических лигандов сигнальных клеточных путей, поэтому прикрепление к ним вируса может повреждать или активировать соответствующие биохимические пути и изменять метаболизм клеток.
В качестве клеточных рецепторов вирусами используются белки CD4 (ВИЧ), HveA (герпесвирусы), ангиотензинконвертирующий фермент (тяжёлый острый респираторный синдром — ТОРС, вирус гастроэнтерита), белок клеточной адгезии JAM-1 (реовирусы), внутриклеточный адгезивный белок ICAM-1 (риновирусы), интегрины (эховирусы), CD46 (вирус краснухи), CD55 (эховирусы, вирусы КоксакиВ), CD155 (полиовирус), клеточный рецептор ламинина (вирус Синдбис), CAR (вирусы Коксаки А и В, аденовирусы), р3-интегрин (буньявирусы), рецептор фактора роста нейронов (вирус бешенства), α-дистрогликан (арена- вирусы) и др.
Из углеводных соединений вирусы используют сиалосодержащие гликаны (вирусы гриппа, парамиксо-, парво-, полиомавирусы), сульфатированные производные гепарина (цитомегало- и герпесвирусы), галактозасодержащие гликаны (альтернативный рецептор ВИЧ) и др.
Помимо начального поискового рецептора прикрепления ряд вирусов вовлекают дополнительные
клеточные белки (т.н. корецепторы), которые входят в состав начального вирус-клеточного комплекса и способствуют переходу фазы адсорбции вируса в необратимую фазу входа вируса в клетку.
Другим важным элементом клеточной адсорбции вирусов является клеточный актин, микросеть которого формирует кортекс под плазматической мембраной клетки. Этот апикальный кортекс служит противовирусным барьером, и вирусы различных семейств преодолевают его с помощью различных механизмов.
После начального прикрепления к клетке вирус перемещается по её поверхности и собирает компоненты рецепторного комплекса, и этот процесс и последующее начало эндоцитоза осуществляются при участии микросети актина. Важно подчеркнуть, что апикальная актиновая сеть служит важным компонентом вирусного внедрения в клетку-мишень: её повреждение с помощью деполимеризирующих агентов типа цитохолазина В или латрункулина А ведёт к торможению вирусного входа в клетку-мишень. Актиновый кортекс имеет исключительно большое значение при инфекции клеток «поляризованного» эпителия в респираторном и кишечном тракте такими вирусами, как ротавирусы, вирусы гриппа, адено-, герпес- и коксакивирусы и др.
Второй этап — вход в клетку и «раздевание» вируса.
После адсорбции вируса наступает фазавхода вируса в клетку. Эта фаза состоит из двухсцепленных между собой процессов: преодолениявирусом клеточного барьера плазматическоймембраны и удаления защитной оболочкивируса и внутриклеточного высвобождения вирусногогенома.
Существует два принципиальных пути входа вирусов в клетку: посредством слияния вирусной оболочки и плазматический мембраны клетки на её поверхности (этот путь присущ ряду оболочечных вирусов) и посредством клеточного механизма рецепторного эндоцитоза, когда после адсорбции на клеточных рецепторах вирус инвагинируется участком плазматической мембраны и оказывается внутри эндоцитарной вакуоли, из которой он также выходит через слияние с клеточной мембраной (у оболочечных вирусов) или путём перфорации эндосомальной стенки (у безоболочечных вирусов).
Инвагинация вирусов на плазматической мембране может происходить в обогащённых клатрином углублениях («клатриновых ямках») либо в т.н. «плотиках», обогащённых холестеролом и содержащих кавеолин («кавеолы»). Первый путь внедрения характерен для парамиксо-, альфа-, герпес-, ретровирусов (включая ВИЧ, вирус осповакцины и другие вирусы), тогда как большинство вирусов, таких как вирусы гриппа, полио-, адено-,рабдо-, тога- и др., используют эндоцитарный путь входа в клетку. Некоторые вирусы, такие как вирус гриппа, полиомы и герпес-вирус, могут использовать и третий эндоцитарный путь, не связанный ни с клатрином, ни с кавеолином и пока малоизученный. Следует также отметить, что у большинства вирусов основная популяция частиц внедряется по одному из указанных путей, тогда как минорные фракции вируса могут входить в клетку по другим возможным путям, что, вероятно, обусловлено свойством вирусов связываться с различными типами клеточных рецепторов.
Общая схема проникновения

Проникновение через эндоплазматическую мембрану:
1. Фузия;
2. Эндоцитоз;
3. Поро-зависимый эндоцитоз.
Слияние на плазматической мембране происходит обычно при нейтральном pH питательной среды в клеточной культуре или физиологической жидкости в организме.
При эндоцитозе слияние вирусной и клеточной мембран или перфорация («пробивание») последней происходят в эндосомах, имеющих кислый pH, который поддерживается клеточным АТФ-зависимым протоновым насосом на уровне 6,5-5,0 в различных зонах цитоплазмы клеток. Такое закисление вызывает активацию вирусных белков, ответственных за выход и раздевание вируса и, таким образом, служит сигналом начала данного поэтапного процесса. У некоторых вирусов (вирусы Эбола и ТОРС-ассоциированный коронавирус) процесс слияния требует участия протеаз, таких как катепсин L и В.
Способ вхождения в клетку тесно связан с механизмом «раздевания», или депротеинизации, вируса. Этот процесс имеет несколько этапов и контролируется в основном вирусными белками слияния (фузии).
У оболочечных вирусов существует два класса таких белков, различающихся по механизму функционирования их фузионных пептидов. Типичный представитель класса I — белок НА вируса гриппа А, имеющий терминальный пептид слияния, а типичные представители класса II — белки слияния флави- и альфавирусов, у которых сливающий пептид имеет интрамолекулярную локализацию. В результате слияния вирусной и клеточной мембран происходит раскрытие вириона и его внутренний нуклеокапсид, содержащий геномную нуклеиновую кислоту, оказывается во внутриклеточном пространстве.
У безоболочечных вирусов такой выход нуклеокапсида осуществляется вирусными белками, которые делают локальный лизис или формируют белковые поры в окружающей клеточной мембране.
«Раздевание» вируса и выход нуклеокапсида — это запрограммированный процесс кооперативных конформационных и функциональных превращений наружных вирионных белков, пусковым моментом которого служит контакт вируса с клеточными рецепторами и/или кислый pH эндосом.
Дата добавления: 2018-06-01; просмотров: 1462; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
