Окислительно-восстановительное титрование
(метод перманганатометрии.)
Задача 10.1.
Вычислить эквивалентную массу перманганата калия, если известно, что окислительно-восстановительная реакция протекает в кислой среде.
Решение:
В кислой среде перманганат – ион MnO4– восстанавливается до иона Mn2+ . Уравнение полуреакции восстановления:
MnO4– + 8H+ + 5e- → Mn2+ + 4H2O
Из него видно, что каждый перманганат ион присоединяет в кислой среде пять электронов. Фактор эквивалентности окислителей и восстановителей вычисляют, исходя из числа электронов, отданных или принятых одной молекулой вещества. В нашем примере число электронов принятых одной молекулой окислителя KMnO4 равно пяти. Поэтому:
 KMnO4 =
KMnO4 =  ,
,
М(KMnO4) = 158,03 г/моль
Поэтому эквивалентная масса перманганата калия вычисляется по формуле:
Мэкв(KMnO4) =  М(KMnO4) =
М(KMnO4) = 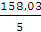 = 31,61 г/моль
= 31,61 г/моль
Задача 10.2.
Вычислить нормальную концентрацию раствора перманганата калия, если известно, что на титровании в кислотной среде растворённой навески щавелевой кислоты, массой 0,8530 г израсходовано 10,2 мл раствора перманганата калия.
Решение:
Составим уравнение реакции:
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + 10CO2↑ + K2SO4 + 8H2O
Метод полуреакций:
MnO4– + 8H+ + 5e- → Mn2+ + 4H2O
C2O42- - 2e- → 2CO2
По закону эквивалентов количество эквивалентов всех участвующий в химической реакции веществ должны быть равными, поэтому:
n экв KMnO4 = n экв H2C2O4 (1)
Сн (KMnO4) 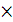 V(KMnO4) = n экв H2C2O4 (2)
V(KMnO4) = n экв H2C2O4 (2)
Количество эквивалентов H2C2O4 определим по формуле:
|
|
|
n экв H2C2O4 = 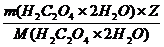 (3), где
(3), где
фактор эквивалентности  (H2C2O4) полуреакции окисления иона восстановителя равен
(H2C2O4) полуреакции окисления иона восстановителя равен  .
.
 (H2C2O4) =
(H2C2O4) =  , M(H2C2O4
, M(H2C2O4 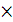 2H2O) = 126,02 г/моль
2H2O) = 126,02 г/моль
По формуле (3):
n экв H2C2O4 = 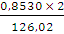 = 0,0135 моль
= 0,0135 моль
Из формулы (2) следует:
Сн (KMnO4) = 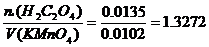 моль/л
моль/л
Задача 10.3.
Вычислить массовую долю чистого сульфата железа (II) в образце, если из навески его массой 10,10 г приготовлено 200 мл раствора, на титрование 10 мл которого израсходовано 5,5 мл раствора перманганата калия, титр которого равен 0,03082 г/мл. Реакция происходит в кислой среде.
Решение:
1) Составим уравнение взаимодействия сульфата железа (II) c перманганатом калия в кислой среде, коэффициенты расставим при помощи метода полуреакций:
2KMnO4 + 10FeSO4 + 8H2O → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
MnO4– + 8H+ + 5e- → Mn2+ + 4H2O
2Fe2+ - 2e- → 2Fe3+
2) Нормальную концентрацию сульфата железа (II) определим по закону эквивалентов:
n экв KMnO4 = n экв FeSO4 (1)
Сн (KMnO4) 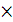 V(KMnO4) = Сн (FeSO4)
V(KMnO4) = Сн (FeSO4) 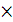 V(FeSO4) (2)
V(FeSO4) (2)
Сн (FeSO4) = 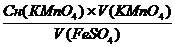 (3)
(3)
3) Нормальную концентрацию перманганата калия определим исходя из титра его раствора (см. задачу 3):
Т =  = Сн (KMnO4) =
= Сн (KMnO4) = 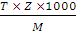 (4)
(4)
Фактор эквивалентности  для KMnO4 из полуреакции его восстановления равен
для KMnO4 из полуреакции его восстановления равен  .
.
 (KMnO4) =
(KMnO4) =  , M(KMnO4) = 158,03 г/моль
, M(KMnO4) = 158,03 г/моль
По формуле (4) определим нормальную концентрацию перманганата калия:
|
|
|
Сн (KMnO4) = 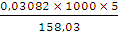 = 0,9751 моль/л
= 0,9751 моль/л
По формуле (3) определим нормальную концентрацию сульфата железа(II):
Сн (FeSO4) = 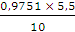 = 0,5363 моль/л
= 0,5363 моль/л
4) Определим массу сульфата железа (II) в анализируемом растворе:
m(FeSO4)= Сн(FeSO4) 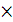
 (FeSO4)
(FeSO4) 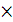 М(FeSO4)
М(FeSO4) 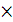 V (5)
V (5)
Фактор эквивалентности  с учётом полуреакции окисления сульфата железа (II):
с учётом полуреакции окисления сульфата железа (II):
 (FeSO4) =
(FeSO4) =  (так как одна молекула FeSO4 отдаёт 1е)
(так как одна молекула FeSO4 отдаёт 1е)
М(FeSO4) = 151,87 г/моль
m(FeSO4) = 0,5363 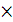
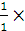 151,87
151,87 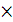 0,2 = 16,2903 г
0,2 = 16,2903 г
5) Массовую долю сульфата железа (II) в образце вычислим по формуле:
ω (FeSO4) = 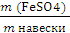 =
= 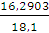 = 0,90001 или 90%
= 0,90001 или 90%
Справочные данные
Приложение А.
Термодинамические свойства некоторых веществ.
| Формула вещества | ∆Нfo,298, кДж*моль-1 | So298, Дж*моль-1*K-1 | ∆Gfo,298, кДж*моль-1 |
| Al(к.) Al2O3(к.) Al2(SO4)3(к.) B(к.) B2O3(к.) Br2(г.) C(графит) CH3OH(ж.) CH4(г.) C2H2(г.) C2H4(г.) CO(г.) COCl2(г.) CO2(г.) Ca(к.) CaO(к.) Cl2(г.) Cu(к.) CuO(к.) Fe(к.) FeO(к.) FeS2(к.) Fe2O3(к.) Fe3O4(к.) H2(г.) HBr(г.) HCl(г.) HI(г.) H2O(ж.) H2O(г.) H2S(г.) I2(г.) Mg(к.) MgCl2(к.) MgO(к.) Mn(к.) MnO2(к.) N2(г.) NH3(г.) NH4NO3(к.) NO(г.) NOCl(г.) NO2(г.) N2O(г.) N2O4(г.) NaAlO2(к.) Na2O(к.) O2(г.) PCl3(г.) PCl5(г.) Pb(к.) PbO(к.) Sромб. SO2(г.) SO2Cl2(г.) SO3(г.) Si(к.) SiC(к.) SiCl4(г.) SiO2(к.) Ti(к.) TiCl4(ж.) TiO2(к.) W(к.) WO3(к.) Zn(к.) ZnO(к.) | 0 -1675,69 -3441,80 0 -1270,43 30,91 0 -238,57 -74,85 226,75 52,30 -110,53 -219,50 -393,51 0 -635,09 0 0 -162,00 0 -264,85 -177,40 -822,16 -1117,13 0 -36,38 -92,31 26,36 -285,83 -241,81 -20,60 62,43 0 -644,80 -601,49 0 -521,49 0 -45,94 -365,43 91,26 52,59 34,19 82,01 11,11 -1133,03 -417,98 0 -287,02 -374,89 0 -219,28 0 -296,90 -363,17 -395,85 0 -66,10 -657,52 -910,94 0 -804,16 -944,75 0 -842,91 0 -348,11 | 28,33 50,92 239,20 5,86 53,84 245,37 5,74 126,78 186,27 200,82 219,45 197,55 283,64 213,66 41,63 38,07 222,98 33,14 42,63 27,15 60,75 52,93 87,45 146,19 130,52 198,58 186,79 206,48 69,95 188,72 205,70 260,60 32,68 89,54 27,07 32,01 53,14 191,50 192,66 151,04 210,64 263,50 240,06 219,83 304,35 70,29 75,06 205,04 311,71 364,47 64,81 66,11 31,92 248,07 311,29 256,69 18,83 16,61 330,95 41,84 30,63 252,40 50,33 32,64 75,90 41,63 43,51 | 0 -1582,27 -3100,87 0 -1191,29 3,14 0 -166,27 -50,85 209,21 68,14 -137,15 -205,31 -394,37 0 -603,46 0 0 -134,26 0 -244,30 -166,05 -740,34 -1014,17 0 -53,43 -95,30 1,58 -237,23 -228,61 -33,50 19,39 0 -595,30 -569,27 0 -466,68 0 -16,48 -183,93 87,58 66,37 52,29 104,12 99,68 -1069,20 -379,26 0 -267,98 -305,10 0 -189,10 0 -300,21 -318,85 -371,17 0 -67,7 -617,62 -856,67 0 -737,32 -889,49 0 -764,11 0 -318,10 |
|
|
|
Приложение Б.
Константы диссоциации некоторых слабых электролитов в водных растворах при 25°С.
| Кислота | Кк | Основание | Ко |
| HF | 6,67*10-4 | NH4OH | 1,76*10-5 |
| HCN | 4,93*10-10 | Al(OH)3 K3 | 1,38*10-9 |
| HAsO2 | 6,03*10-10 | Cd(OH)2 K2 | 4,20*10-7 |
| HBrO | 2,06*10-9 | Co(OH)2 K2 | 7,90*10-6 |
| HClO | 2,82*10-8 | Cr(OH)3 K2 K3 | 3,50*10-9 8,90*10-11 |
| HIO | 2,29*10-11 | Cu(OH)2 K2 | 2,20*10-7 |
| HNO2 | 5,13*10-4 | Fe(OH)2 K2 | 5,50*10-8 |
| H2O2 | 2,40*10-12 | Mg(OH)2 K2 | 2,60*10-3 |
| H3PO2 | 7,94*10-2 | Mn(OH)2 K2 | 3,90*10-4 |
| HCOOH | 1,78*10-4 | Ni(OH)2 K2 | 8,30*10-4 |
| CH3COOH | 1,74*10-5 | Pb(OH)2 K1 K2 | 5,00*10-4 1,40*10-8 |
| H2S K1 K2 | 1,05*10-7 1,23*10-13 | Zn(OH)2 K1 K2 | 1,30*10-5 4,90*10-7 |
| H2Se K1 K2 | 1,55*10-4 1,00*10-11 | ||
| H2B4O7 K1 K2 | 1,80*10-4 2,00*10-8 | ||
| H2CO3 K1 K2 | 4,27*10-7 4,68*10-11 | ||
| H2C2O4 K1 K2 | 6,46*10-2 6,17*10-5 | ||
| H2CrO4 K2 | 3,16*10-7 | ||
| H2MoO4 K2 | 1,00*10-6 * | ||
| H3PO3 K1 K2 | 1,00*10-2 2,57*10-7 | ||
| H2SO3 K1 K2 | 1,58*10-2 6,31*10-8 | ||
| H2SeO3 K1 K2 | 2,45*10-3 4,79*10-9 | ||
| H2SiO3 K1 K2 | 2,20*10-10 * 1,60*10-12 * | ||
| H2WO4 K2 | 2,19*10-4 | ||
| H3AsO4 K1 K2 K3 | 5,50*10-3 1,07*10-7 3,02*10-12 | ||
| H3PO4 K1 K2 K3 | 7,24*10-3 6,17*10-8 4,57*10-13 | ||
Примечание:
|
|
|
Значения констант диссоциации, отмеченные астериксом (*), отвечают температуре 18°С.
Приложение В.
Произведение растворимости
некоторых малорастворимых электролитов при 25°С.
| Электролит | ПР | Электролит | ПР |
| Ag2CO3 Ag2C2O4 AgCl Ag2CrO4 AgI AgIO3 Ag2S Ag2SO4 Al(OH)3 AlPO4 BaCO3 BaC2O4 BaCrO4 BaF2 BaSO3 BaSO4 CaCO3 CaC2O4 CaF2 CaMoO4 CaSO3 CaSO4 CaWO4 CdCO3 CdC2O4 Cd(OH)2 CdS | 8,7*10-12 1,1*10-11 1,8*10-10 1,2*10-12 2,3*10-16 3,2*10-8 7,2*10-50 1,2*10-5 5,7*10-32 1,7*10-19 4,9*10-9 1,1*10-7 1,1*10-10 1,7*10-6 8,0*10-7 * 1,8*10-10 4,4*10-9 2,3*10-9 * 4,0*10-11 3,2*10-9 3,2*10-7 * 3,7*10-5 1,6*10-9 2,5*10-14 1,5*10-8 * 4,3*10-15 6,5*10-28 | CoCO3 CuS FeCO3 FeO(OH) FeS HgO HgS Li3PO4 MgF2 MnCO3 MnS NiCO3 PbCrO4 PbS PbWO4 RaSO4 SrCO3 SrCrO4 SrF2 Sr3(PO4)2 SrSO4 Tl2CrO4 ZnCO3 ZnC2O4 Zn(OH)2 ZnS(кубич.) | 1,5*10-10 1,4*10-36 2,9*10-11 2,2*10-42 3,4*10-17 3,3*10-26 1,4*10-45 3,2*10-9 * 6,4*10-9 4,9*10-11 1,1*10-13 1,3*10-7 2,8*10-13 8,7*10-29 4,5*10-12 4,3*10-11 5,3*10-10 2,7*10-5 2,5*10-9 1,0*10-31 * 2,1*10-7 1,0*10-12 5,3*10-11 1,5*10-9 * 3,0*10-16 1,2*10-25 |
Примечание:
Значения произведений растворимости, отмеченные астериксом (*), отвечают комнатной температуре (18 – 25°С).
Приложение С.
Стандартные электродные потенциалы 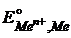 некоторых металлов
некоторых металлов
В водных растворах при 298К
| Электрод | 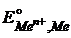 ,B ,B
| Электрод | 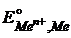 ,B ,B
| Электрод | 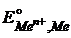 ,B ,B
|
| Li+, Li | -3,045 | A13+, Al | -1,662 | Ni2+, Ni | -0,250 |
| Rb+,Rb | -2,925 | Mn2+, Mn | -1,180 | Sn2+, Sn | -0,136 |
| К+,К | -2,925 | Cr2+, Cr | -0,913 | Pb2+, Pb | -0,126 |
| Cs+, Cs | -2,923 | Zn2+, Zn | -0,763 | Fe3+, Fe | -0,036 |
| Ra2+, Ra | -2,916 | Cr3+, Cr | -0,740 | H+,H2 | 0,000 |
| Ba2+, Ba | -2,906 | Fe2+, Fe | -0,440 | Bi3+,Bi | +0,215 |
| Ca2+, Ca | -2,866 | Cd2+, Cd | -0,403 | Cu2+, Cu | +0,337 |
| Na+, Na | -2,714 | In3+,In | -0,343 | Ag+, Ag | +0,799 |
| Mg2+, Mg | -2,363 | Tl+, Tl | -0,336 | Hg2+, Hg | +0,854 |
| Be2+, Be | -1,850 | Co2+, Co | -0,277 | Au3+,Au | +1,498 |
Приложение Д.
Общие константы нестойкости некоторых комплексных ионов
в водных растворах при 25°С.
| Комплексный ион | Кн | Комплексный ион | Кн |
| [Ag(CN)3]2- [Ag(S2O3)2]3- [Ag(NH3)2]+ [Ag(NO2)2]- [AlF6]3- [Cd(CN)4]2- [Cd(NH3)4]2+ [Cu(CN)4]2- [Co(NH3)4]2+ [Ni(NH3)2]2+ [Ni(NH3)4]2+ [PbCl4]2- [PbBr4]2- [Pb(S2O3)4]6- | 2,80*10-21 3,47*10-14 9,3·10-8 1,5·10-3 1,48*10-21 7,76*10-18 2,8·10-7 5,00*10-28 2,8·10-7 1,9·10-9 3,4·10-8; 1,0·10-16 3,16·10-21 6,31·10-8 | [Fe(CN)6]4- [Fe(CN)6]3- [Hg(CN)4]2- [Hg(SCN)4]2- [HgCl4]2- [HgI4]2- [HgBr4]2- [Zn(CN)4]2- [Zn(OH)4]2- [Zn(NH3)4]2+ [BiCl6]3- [BiI6]3- [Bi(SCN)6]3- | 1,26*10-37 1,26*10-44 4,0·10-42 5,9·10-22 6,03*10-16 1,48*10-30 1,0·10-21 2,40*10-20 3,6·10-16 3,46·10-10 3,8·10-7 7,94·10-20 5,89·10-5 |
Дата добавления: 2018-06-01; просмотров: 490; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
