Строение и некоторые свойства молекул
Изобразите пространственные конфигурации молекул, приведенных в вашем варианте задания, напишите дисплейную (структурную) формулу каждого соединения и выполните следующие задания:
А) изобразите орбитальную диаграмму электронной оболочки центрального атома, учитывая состояние (основное или возбужденное) при образовании молекул;
Б) укажите тип гибридизации орбиталей центрального атома каждой молекулы, форму каждой молекулы, а также число σ- и π-связей в каждой молекуле;
В) определите, являются ли молекулы полярными (µ ≠ 0) или неполярными (µ = 0), ответ обоснуйте;
Г) определите тип межмолекулярного взаимодействия, вносящий наиболее существенный вклад при конденсации каждого соединения, и обоснуйте ваш ответ.
Таблица 4
| Формулы молекул |
| SF6 SbF3 POF3 |
Ответ: 1. Соединение SF6 - гексафторид серы.
а) Полная электронная формула центрального атома серы имеет вид:
S 1s22s22p63s23p4.
электронная формула атома фтора имеет вид:
F 1s22s22p5
Электронно-графическая формула атома S (валентные электроны) в основном состоянии выглядит так:
S 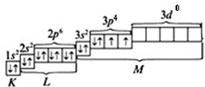
Электронно-графическая формула атома F (валентные электроны) в основном состоянии выглядит так:
F 
При сообщении дополнительной энергии электрон из 3р-состояния переходит в одну из пустых 3d-ячеек. И тогда электоронно-графическая формула атома S в возбужденном состоянии будет выглядеть так:
S* 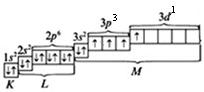
Однако, для образования молекулы SF6 необходимо шесть неспаренных электронов. В результате сообщении дополнительной энергии электрон из 3s-состояния переходит в одну из пустых 3d-ячеек. И тогда электоронно-графическая формула атома S будет выглядеть так:
|
|
|
S** 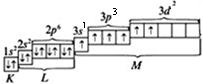
б) Для образования молекулы SF6 центральный атом предоставляет одно s-облако, три p-облака и два d-облака. 6 атомов фтора представляют по 1 р-облаку. Атом серы находится в состоянии sp3d2-гибридизации и, следовательно, молекула SF6 имеет октэдрическую форму.
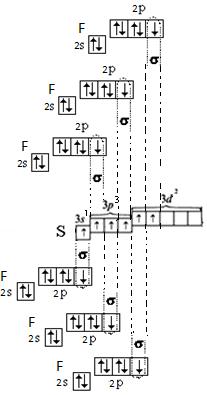
Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Т. о. в молекуле SF6 шесть σ-связи.
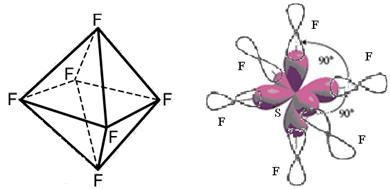
Перекрывание sp3d2-орбиталей серы и p-орбиталей фтора в молекуле SF6.
в) В соединении гексафторид серы (SF6) величины относительных электроотрицательностей ЭО для составляющих элементов следующие: фтора – 4,0, серы – 2,5. ∆ЭО = 1,5. 0 < ∆ЭО < 1,7 по шкале Полинга, следовательно, в этом соединении атомы связаны ковалентной полярной связью, причем электронная плотность связи смещена в сторону более электроотрицательного фтора. Однако, молекула имеет симметричное строение и моменты связей S – F и электронной пары направлены в противоположные стороны, поэтому при векторном сложении они компенсируются и в целом молекула становится неполярной (μ=0).
|
|
|
г) Межмолекулярное взаимодействие имеет электрическую природу и складывается из сил притяжения (ориентационных, индукционных и дисперсионных) и сил отталкивания. Для молекулы SF6 (т.к. она является неполярной) характерно дисперсионное взаимодействие молекул при конденсации. Оно обусловлено взаимодействием молекул друг с другом за счет их мгновенных микродиполей. Синхронное появление и исчезновение микродиполей разных молекул сопровождается их притяжением.
2. Соединение SbF3 - фторид сурьмы (III).
а) Электронная формула внешнего слоя центрального атома сурьмы имеет вид:
Sb 5s25p3.
электронная формула атома фтора имеет вид:
F 1s22s22p5
Электронно-графическая формула атома Sb (валентные электроны) в основном состоянии выглядит так:
Sb 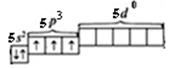
Электронно-графическая формула атома F (валентные электроны) в основном состоянии выглядит так:
F 
б) Для образования молекулы SbF3 центральный атом предоставляет одно s-облако, три p-облака. 3 атома фтора представляют по 1 р-облаку. Атом сурьмы находится в состоянии sp3-гибридизации и в атоме сурьмы имеется 1 неподеленная электронная пара. Гибридные ЭО неподеленных пар электронов (в пространственных формулах не показаны малые области этих облаков) не принимают участия в образовании связей, и следовательно, молекула SbF3 имеет форму тригональной пирамиды. Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Т. о. в молекуле SbF3 три σ-связи.
|
|
|
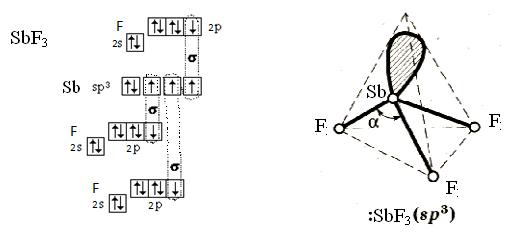
Перекрывание sp3-орбиталей сурьмы и p-орбиталей фтора в молекуле SbF3.
в) В соединении трифторид сурьмы (SbF3) величины относительных электроотрицательностей ЭО для составляющих элементов следующие: фтора – 4,0, сурьмы – 1,9. ∆ЭО = 2,1. ∆ЭО > 1,7 по шкале Полинга, следовательно, в этом соединении атомы связаны ионной химической связью. Молекула в целом является полярной (µ ≠ 0).
г) Для молекулы SbF3 характерно ориентционное (диполь-дипольное) межмолекулярное взаимодействие, вносящий наиболее существенный вклад при конденсации соединения. В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются.
Также для молекулы SbF3 характерно донорно-акцепторное взаимодействие молекул. Оно возникает за счет неподеленной электронной пары у атома сурьмы (донор) и свободной орбитали другой молекулы. Такой молеулой, например, может служить BF6, в которой атом бора имеет свободную орбиталь и выступает в качестве акцептора. За счет донорно-акцепторного взаимодействия между этими молекулами образуется соединение состава BF6∙ SbF3.
|
|
|
3. Соединение POF3 - оксид-трифторид фосфора (V).
а) Полная электронная формула центрального атома фосфора имеет вид:
Р 1s22s22p63s23p3.
электронная формула периферийного атома фтора имеет вид:
F 1s22s22p5
электронная формула периферийного атома кислорода имеет вид:
О 1s22s22p4
Электронно-графическая формула атома Р (валентные электроны) в основном состоянии выглядит так:
Р 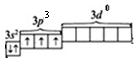
При сообщении дополнительной энергии электрон из 3s-состояния переходит в одну из пустых 3d-ячеек. И тогда электоронно-графическая формула атома Р в возбужденном состоянии будет выглядеть так:
Р* 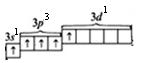
Электронно-графическая формула атома F (валентные электроны) в основном состоянии выглядит так:
F 
Электронно-графическая формула атома О (валентные электроны) в основном состоянии выглядит так:
О 
б) Три атома фтора представляет по 1 р-облаку. Атом кислорода представляет 2 р-облака Для образования молекулы POF3 центральный атом предоставляет одно s-облако, три p-облака и одно d-облако, которое участвует в образовании  -связи, таким образом атом фосфора находится в состоянии sp3-гибридизации и следовательно, молекула POF3 имеет форму тетраэдра.
-связи, таким образом атом фосфора находится в состоянии sp3-гибридизации и следовательно, молекула POF3 имеет форму тетраэдра.
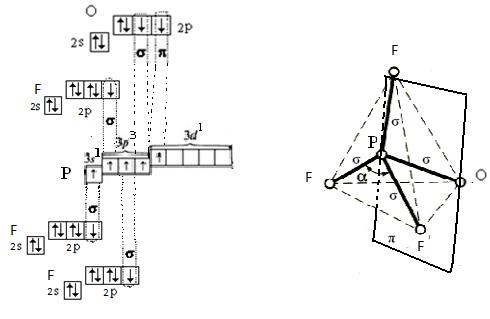
Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Облако пятого валентного электрона атома фосфора располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов фосфора и кислорода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую менее прочную ковалентную π-связь между атомами. Т.о. в молекуле POF3 четыре σ-связи и одна π-связь.
в) В соединении POF3 величины относительных электроотрицательностей ЭО для составляющих элементов следующие: фтора – 4,0, фосфора – 2,1; кислорода – 3,5. ∆ЭОР-F = 1,9; ∆ЭОP-О = 1,4 (µ ≠ 0). 0 < ∆ЭО < 1,7 по шкале Полинга, следовательно, в этом соединении атомы связаны ковалентной полярной связью.
г) Для молекулы POF3 характерно ориентционное (диполь-дипольное) межмолекулярное взаимодействие, вносящий наиболее существенный вклад при конденсации соединения. В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются.
Контрольное задание № 4
Дата добавления: 2018-06-01; просмотров: 1990; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
