Гетерогенные процессы и равновесия
При стандартных температуре и давлении приготовлен насыщенный водный раствор электролита 1. К одной части полученного раствора добавили электролит 2, к другой электролит 3. Используя формулы веществ электролитов, приведенных в вашем варианте задания, определите процессы, протекающие в полученных гетерогенных системах, напишите уравнения этих процессов и выполните следующие задания:
а) вычислите растворимость электролита в чистой воде ( 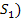 ;
;
б) вычислите массу ионов каждого вида и массу электролита 1, содержащихся в 1 л насыщенного водного раствора этого электролита.
Таблица 12
| Электролит 1 | Электролит 2 | Электролит 3 |
| SrSO4 | KNO3 | Na2SO4 |
Решение: Электролит 1 - SrSO4 (сульфат стронция) является малорастворимым соединением.
Влияние добавления электролита 2 KNO3 к части электролита 1. KNO3 (нитрат калия) – сильный электролит. В присутствии сильного растворимого электролита, не имеющего общих ионов с осадком, увеличивается ионная сила раствора, уменьшаются (при I < 0,1 М) коэффициенты активности ионов осадка. Это приводит к тому, что величина произведения растворимости малорастворимого соединения в солевом растворе, насыщенном посторонними ионами, возрастает по сравнению с величиной произведения растворимости данного электролита в чистой воде, что вызывает повышенную растворимость электролита. Описываемое явление известно под названием солевого эффекта.
|
|
|
Влияние добавления электролита 3 Na2SO4 к части электролита 1. В чистой воде равновесные концентрации катиона и аниона определяются молярной величиной растворимости соединения SrSO4 и стехиометрией равновесия:
[Sr2+] = [SO42-] = 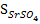 .
.
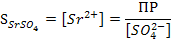
При добавлении Na2SO4 концентрация сульфат-ионов в растворе над осадком будет больше концентрации ионов стронция. При этом можно считать, что избыток сульфат-ионов прибавлен к насыщенному водному раствору SrSO4. Отсюда общая концентрация сульфат-ионов в растворе будет равна 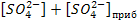 , где
, где 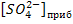 - концентрация карбонат-ионов, прибавленных в избытке к насыщенному водному раствору чистого электролита SrSO4.
- концентрация карбонат-ионов, прибавленных в избытке к насыщенному водному раствору чистого электролита SrSO4.
Следовательно,
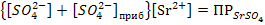
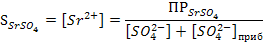
Таким образом, растворимость малорастворимого электролита SrSO4имеет наибольшее значение лишь в насыщенном водном растворе этого электролита и уменьшается при добавлении избытка Na2SO4, содержащего одноименные ионы.
а) Вычислим растворимость электролита SrSO4 в чистой воде ( 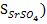 .
.
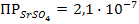
В чистой воде равновесные концентрации катиона и аниона определяются молярной величиной растворимости соединения ВaCO3 и стехиометрией равновесия:
[Sr2+] = [SO42-] = 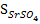 .
.
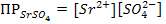
Тогда
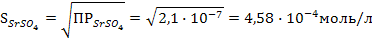
б) Вычислим массу ионов каждого вида и массу электролита 1, содержащихся в 1 л насыщенного водного раствора этого электролита
|
|
|
[Sr2+] = [SO42-] = 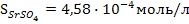
Следовательно, в 1 литре раствора содержится n[Sr2+] = n[SO42-] 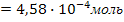
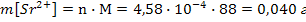
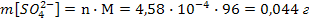
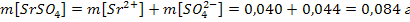
Контрольное задание № 7
Дата добавления: 2018-06-01; просмотров: 544; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
