Химическая классификация и номенклатура неорганических соединений
Используя химические элементы, приведенные в вашем варианте задания составьте химические формулы всех возможных оксидов, гидроксидов (основных, кислотных, амфотерных) и выполните следующие задания:
А) назовите и классифицируйте полученные соединения;
Б) составьте уравнения всех возможных реакций взаимодействия полученных оксидов с серной кислотой;
В) составьте уравнения всех возможных реакций взаимодействия полученных оксидов с гидроксидом калия.
Таблица 1
| Названия элементов с указанием степени окисления |
| Стронций Углерод(IV) Хром (III) |
Ответ:А)Оксиды неорганических соединений:
SrO – оксид стронция – основный оксид
СO2 – диоксид углерода – кислый оксид
Cr2O3 – оксид хрома – амфотерный оксид
Гидроксиды неорганических элементов:
Sr(OH)2 – гидроксид стронция – основный гидроксид
H2СO3 – угольная кислота – двухосновная кислота
Cr(OH)3 – гидроксид хрома – амфотерный гидроксид
Б) Уравнения реакций взаимодействия оксидов с серной кислотой:
SrO + H2SO4 → SrSO4↓ + H2O (образуется сульфат стронция и вода)
СO2 + H2SO4 ≠
Cr2O3 + 3H2SO4  Cr2(SO4)3 + 3H2O (образуется сульфат хрома и вода)
Cr2(SO4)3 + 3H2O (образуется сульфат хрома и вода)
В) Уравнения реакций взаимодействия оксидов с гидроксидом калия:
SrO + КОН ≠
СO2 + КОН → KHСO3 (образуется гидрокарбонат калия)
Cr2O3 + 2КОН  2KCrO2 + H2O (образуется хромит калия и вода)
2KCrO2 + H2O (образуется хромит калия и вода)
Генетическая связь между отдельными классами неорганических соединений
|
|
|
Напишите уравнения реакций, при помощи которых можно осуществить приведенные превращения. Укажите (при необходимости) условия протекания этих реакций. Назовите каждое из приведенных соединений.
Таблица 2
| «Цепочка» превращений |
| H2O → H2 → NH3 → NH4Cl → NH4NO3 → N2 |
Ответ:1. Вода реагирует при комнатной температуре с активными металлами (натрий, калий, кальций, барий и др.) с образованием гидроксида металла и газообразного водорода
2H2O + 2Na → 2NaOH + H2↑
2. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота, реакцию следует проводить при высоком давлении:
N2 + 3H2 ↔ 2NH3
3. Аммиак взаимодействуя с соляной кислотой даёт хлорид аммония:
NH3 + HCl 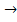 NH4Cl
NH4Cl
4. При взаимодействии хлорида аммония с нитратом серебра образуется белый осадок хлорида серебра и нитрат аммония:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
5. При разложении нитрата аммония при температуре выше 270 ˚С образуется вода и газообразные азот и кислород:
2NH4NO3 → 2N2↑ + O2↑ + 4H2O
Контрольное задание № 2
Характеристика химического элемента и его соединений
Дайте характеристику химического элемента, приведенного в вашем варианте задания, а также простых и сложных соединений, образуемых данным элементом.
|
|
|
Таблица 3
| Химический элемент |
| Углерод |
Ответ: 1. Углерод (С) — элемент четвертой группы второго периода периодической системы химических элементов Д. И. Менделеева. Принадлежит к семейству р-элементов.
2. а) С помощью периодической системы находим, что элемент с химическим символом С – углерод имеет атомный номер 6. Атомный (порядковый) номер элемента равен числу протонов, значит, число протонов (Z) – 6. Массовое число (А) С – углерода равно 12. Массовое число (А) равно сумме числа протонов (Z) и числа нейтронов (N), т.е. A = Z + N
откуда число нейтронов N = A – Z = 12 – 6 = 6.
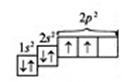
б) Полная электронная формула атома углерода имеет вид:
С 1s22s22p2.
Характеристическая электронная формула атома углерода:
С 2s22p2.
Электронно-графическая формула атома углерода для внешнего и предвнешних уровней будет выглядеть следующим образом:
в) При сообщении дополнительной энергии электрон из 2s-состояния переходит в одну из пустых 2р-ячеек. И тогда электоронно-графическая формула атома С в возбужденном состоянии будет выглядеть так:
С* 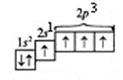
В возбужденном состоянии атом имеет 4 неспаренных электрона.
Характерные степени окисления углерода +4, +3, +2, +1, 0, -1, -2, -3, -4
|
|
|
Максимальная степень окисления атома С +4 (равна числу электронов, отданных данным атомом, и соответствует номеру группы, в которой находится данный элемент), минимальная степень окисления равна -4 (равна числу электронов, принятых данным атомом, для элементов главных подгрупп IV-VII групп минимальная степень окисления определяется по следующей формуле: номер группы минус 8).
3. а) Углерод — является неметаллом. При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства.
Продукты горения углерода в кислороде являются CO и CO2 (монооксид углерода и диоксид углерода соответственно):
2С + О2 → 2СО
С + О2 → СО2
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством металлов углерод образует карбиды, например:
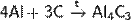
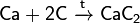
Важна в промышленности реакция углерода с водяным паром:
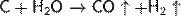
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности.
4. а) Соединение углерода с водородом — метан СН4. Бесцветный газ (в нормальных условиях) без запаха. Вступает с галогенами в реакции замещения, которые проходят по свободно-радикальному механизму:
|
|
|
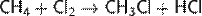
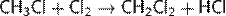


Выше 1400 °C разлагается, образуя ацетилен и водород:
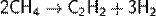
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:

б) - Моноксид углерода - СO. Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. Так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑.
Оксид углерода(II) горит пламенем синего цвета на воздухе при температуре 700˚:
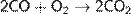
Оксид углерода(II) реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором. В результате реакции образуется фосген:
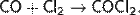
Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
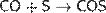
Восстанавливает SO2:
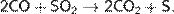
Оксид углерода(II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:

- Диоксид углерода – СО2. По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту.
CO2 + H2O ↔ H2CO3
Реагирует с щёлочами с образованием карбонатов и гидрокарбонатов.
Ca(OH)2 + CO2 = CaCO3↓ + H2O
СО2 + КОН → КНСО3
Оксид углерода(IV) не поддерживает горения. Только некоторые активные металлы горят в нём, так как отнимают кислород:
2Mg + CO2 = 2MgO + C
- Угольная кислота — Н2СО3. Слабая двухосновная кислота с химической формулой. В водных растворах неустойчива, что приводит к разложению части угольной кислоты на воду и диоксид углерода:

Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
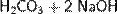 (конц.)
(конц.) 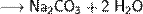
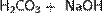 (разб.)
(разб.) 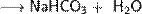
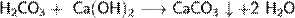
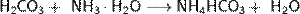
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:

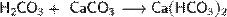
в) Соли углерода: Карбона́ты и ги́дрокарбонаты — соли и эфиры угольной кислоты (H2CO3). Среди солей известны нормальные карбонаты (с анионом СО32−) и кислые или гидрокарбонаты (с анионом НСО3−).
При нагревании кислые карбонаты переходят в нормальные карбонаты:
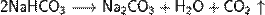
При сильном нагревании нерастворимые карбонаты разлагаются на оксиды и углекислый газ:

Карбонаты реагируют с кислотами сильнее угольной (почти все известные кислоты, включая органические) с выделением углекислого газа:
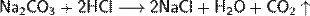
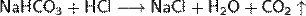
В воде карбонаты и гидрокарбонаты подвергаются гидролизу по аниону:
СО32− + Н2О ↔ НСО3- + ОН-
НСО3- + Н2О ↔ Н2СО3 + ОН-
Вследствие гидролиза растворы их показывают щелочную реакцию.
5. Углерод не склонен к комплексообразованию. В состав комплексных соединений входит только в виде цианид-ионов (CN-) и монооксида углерода, который способен непосредственно реагировать со многими металлами или ионами металлов, образуя комплексные соединения, называемые карбонилами, например Ni(CO)4, Fe(CO)5, Fe2(CO)9, [Fe(CO)4]3, Mo(CO)6, [Co(CO)4]2.
6. Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
7. Монооксид углерода. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:

Угольная кислота образуется при растворении в воде диоксида углерода:
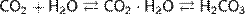
Метан. Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия:
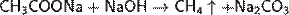
Синильная кислота. Получают прямымсинтезом из аммиака и метана в присутствии платинового катализатора при высокой температуре:
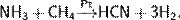
Сероуглерод. В промышленности получают по реакции метана с парами серы в присутствии силикагеля при 500—700 °C в камере из хромоникелевой стали:
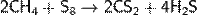
8. Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества. Углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод играет огромную роль в жизни человека. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения.
Графит используется в карандашной промышленности. Способность графита проводить электрический ток позволяет изготавливать из него качественные электроды.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях.
Контрольное задание № 3
Дата добавления: 2018-06-01; просмотров: 537; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
