Энергетика и направленность химических процессов
Закончите химическое уравнение схемы реакции, приведенной в вашем варианте задания в таблице и выполните следующие задания:
А) вычислите стандартную энтальпию 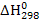 и стандартную энтропию
и стандартную энтропию 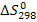 реакции, расчеты приведите;
реакции, расчеты приведите;
Б) вычислите приблизительную равновесную температуру 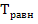 для этой реакции, расчеты приведите и укажите, выше или ниже равновесной температуры реакция может протекать самопроизвольно, ответ поясните;
для этой реакции, расчеты приведите и укажите, выше или ниже равновесной температуры реакция может протекать самопроизвольно, ответ поясните;
В) вычислите стандартную энергию Гиббса 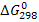 этой реакции и оцените возможность ее самопроизвольного протекания при температуре 298 К, ответ поясните
этой реакции и оцените возможность ее самопроизвольного протекания при температуре 298 К, ответ поясните
Г) по термохимическому уравнению реакции определите массу первого реагента, которая может быть израсходована в ходе реакции при выделении (или поглощении) теплоты Q, равной 10 кДж.
Таблица 5
| Схема превращения |
| FeS2(к) + O2(г) → Fe2O3(к) + SO2(г) |
Решение: Расставляем коэффициенты в уравнении реакции
4FeS2(к) + 11O2(г) → 2Fe2O3(к) + 8SO2(г)
Справочные данные запишем в виде таблицы
| Вещество | ΔH°298, кДж/моль | S°298, Дж/(К∙моль) |
| FeS2(к) | -177,40 | 52,93 |
| O2(г) | 0 | 205,04 |
| Fe2O3(к) | -822,16 | 87,45 |
| SO2(г) | -296,90 | 248,07 |
А) 1. Найдем изменение энтальпии в ходе химической реакции, которое равно разности сумм энтальпий (ΔН0298) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
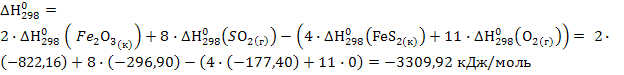 .
.
Отрицательный знак изменения энтальпии ΔH°f; 298 < 0 говорит о том, что реакция протекает с выделением тепла, т. е. реакция экзотермическая.
|
|
|
2. Найдем изменение энтропии в ходе химической реакции, которое равно разности сумм энтропий (S0298) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
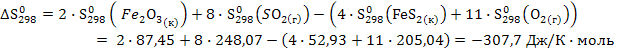
Отрицательный знак изменения энтропии ΔS°f; 298 < 0 говорит о том, что в результате реакции происходит упорядочивание системы.
Б) Система находится в состоянии равновесия при ∆G = 0, т.е. ΔH°f; 298 = Т∙∆S° 298
Откуда равновесную температуру найдем по формуле:
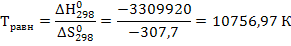
Реакция может протекать самопроизвольно при температуре выше равновесной. Т.к. в этом случае 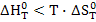 и следовательно
и следовательно 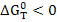 .
.
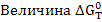 - является критерием самопроизвольного протекания процесса, при
- является критерием самопроизвольного протекания процесса, при 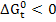 реакция протекает самопроизвольно, при
реакция протекает самопроизвольно, при 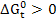 реакция не осуществима, самопроизвольно протекает процесс в обратном направлении.
реакция не осуществима, самопроизвольно протекает процесс в обратном направлении.
В) Изменение стандартной величины энергии Гиббса находим по уравнению
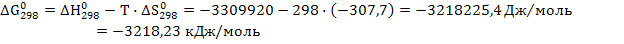
Т.к.∆G < 0 – данная реакция осуществима при стандартных условиях и протекает самопроизвольно в прямом направлении.
Г) Определим количество моль FeS2 израсходованного в ходе реакции при выделении Q = 10 кДж
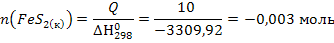
т.е в ходе реакции в израсходовалось 0,003 моль FeS2
Найдем массу израсходованного FeS2
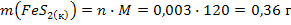
Зависимость скорости химических процессов от концентрации реагирующих веществ, давления и температуры
|
|
|
Используя уравнение реакции и числовые данные таблицы 6, приведенные в вашем варианте задания, определите, как изменится (уменьшится или увеличится, и во сколько раз) скорость прямой реакции (процесс одностадийный), протекающей по данному уравнению, при изменении следующих условий:
А) при увеличении концентрации первого вещества в «а» раз и одновременном уменьшении концентрации второго вещества в «b» раз;
Б) при увеличении давления в системе в «с» раз;
В) при увеличении объема системы в «d» раз;
Г) при понижении (  или повышении (
или повышении ( 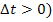 температуры на «
температуры на « 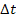 » градусов Цельсия, если условно температурный коэффициент скорости данной реакции γ равен 3,0.
» градусов Цельсия, если условно температурный коэффициент скорости данной реакции γ равен 3,0.
Таблица 6
| Уравнение реакции | а | b | c | d | 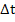
|
| CH4(г) + CO2(г) = 2CO(г) + 2H2(г) | 6 | 3 | 2 | 4 | +65 |
Решение: Кинетическое уравнение в общем виде записывается как произведение концентраций реагентов в степенях, равных стехеометрическому коэффициенту, стоящему перед соответствующим веществом в уравнении реакции. Причем учитывается только концентрация газообразных веществ.
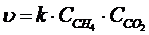
А) при изменении концентраций реагентов используем кинетическое уравнение реакции до изменения концентрации и после.
|
|
|
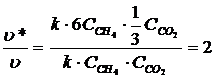
Т.о. при увеличении концентрации СН4 в 6 раз и одновременном уменьшении концентрации CO2 в 3 раза скорость реакции увеличиться в 2 раза.
Б) при увеличении давления в системе в 2 раза концентрации реагентов в газовой фазе увеличатся в 2 раза. Используя кинетическое уравнение, получим
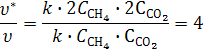
Т. е. скорость реакции увеличится в 4 раза.
В) при увеличении объема (уменьшении давления) системы в 4 раза концентрации реагентов в газовой фазе уменьшаться в 4 раза. Используя кинетическое уравнение, получим
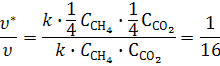
Т. е. скорость реакции уменьшится в 16 раз.
Г) Для вычисления изменения скорости реакции при изменении температуры используем формулу Вант-Гоффа.
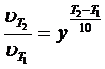
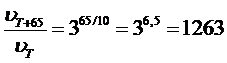
При повышении T на 65 °С скорость реакции увеличится в 1263 раза.
Химическое равновесие
Химическая система находится в замкнутом объеме в состоянии равновесия
aA + bB ↔ cC + dD
Определите направление смещения химического равновесия в системе, приведенной в вашем варианте задания, при изменении условий:
А) при понижении давления;
Б) при уменьшении объема;
В) при уменьшении концентрации продуктов реакции;
Г) при нагревании.
Укажите, как следует изменить температуру и давление (повысить или понизить), чтобы смещение равновесия привело к повышению выхода продуктов реакции. Все ответы поясните.
|
|
|
Таблица 7
| Уравнение обратимой реакции |
| MgCO3(к) = MgO(к) + CO2(г); ΔH > 0 |
Ответ: Согласно принципу Ле-Шателье: если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия.
Определим по принципу Ле-Шателье направление смещения химического равновесия данной реакции:
А) Если реакция протекает с уменьшением числа молей газообразных веществ (Δn < 0), уменьшение общего давления смещает равновесие реакции в сторону исходных реагентов, при увеличении числа молей (Δn > 0) равновесие смещается вправо. В нашем случае реакция протекает с увеличением числа молей газообразных веществ, тогда при понижении давления в системе, равновесие сместится в сторону продуктов реакции.Б) Уменьшение объема системы равносильно повышению давления в системе. Тогда при повышении давления равновесие реакции смещается в направлении образования веществ, занимающих меньший объем. В нашем случае, реакция протекает с увеличением молей газов, следовательно, равновесие сместится в сторону исходных реагентов.
В) Уменьшение концентрации продуктов реакции (отвод продуктов) будет смещать равновесие в сторону увеличения продуктов, т.е. вправо.Г) Положительный знак изменения энтальпии ΔH°f; 298 > 0 говорит о том, что реакция протекает с поглащением тепла, т. е. реакция эндотермическая. Повышение температуры будет смещать равновесие в сторону эндотермической реакции, т.е. в прямую сторону (в сторону продуктов реакции).
Чтобы смещение равновесия привело к повышению выхода продуктов реакции:
- давление в системе необходимо уменьшить, т. к. суммарное количество газообразного вещества в результате реакции увеличивается;
- реакция эндотермическая, поэтому для смещения равновесия вправо необходимо повысить температуру системы.
Контрольное задание № 5
Дата добавления: 2018-06-01; просмотров: 1156; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
