Направление протекания реакций в растворах комплексных соединений. Диссоциация комплексных соединений. Константа нестойкости комплексных ионов
Для реакции, указанной в вашем варианте задания, выполните следующее:
а) Напишите уравнение реакции и установите, в каком направлении и почему она будет протекать;
б) Назовите все комплексные соединения;
в) Напишите реакции диссоциации комплексных соединений;
г) Напишите выражения констант нестойкости комплексных ионов.
K2[PbCl4] + K2S2O3→…
Решение: а) Для комплексных соединений характерными являются реакции внутрисферного замещения. Таким образом, при добавлении тиосульфата калия к K2[PbCl4] можно заместить хлорид-ионы на тиосульфатогруппы.
Полное уравнение реакции будет иметь вид
K2[PbCl4] + 4K2S2O3 ↔ K6[Pb(S2O3)4] + 4KCl
Предсказать течение реакций между комплексными соединениями можно с помощью значения констант нестойкости
Кнестойкости([PbCl4]2-) = 1,0·10-16;
Кнестойкости([Pb(S2O3)4]6-) = 6,31·10-8;
Кнестойкости([PbCl4]2-) < Кнестойкости([Pb(S2O3)4]6-)
т.е более устойчивым является ион [PbCl4]2-. Т. о. реакция будет протекать в обратном направлении.
б) Название комплексных соединений:
K2[PbCl4] – тетрахлороплюмбат (II) калия;
K6[Pb(S2O3)4] – тетратиосульфатоплюмбат (II) калия
в) Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, т. е. практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно.
Реакции диссоциации тетрахлороплюмбат (II) калия
|
|
|
K2[PbCl4] ↔ 2К+ + [PbCl4]2-
[PbCl4]2- ↔ Cl- + [PbCl3]-
[PbCl3]- ↔ Cl- + PbCl2↓
Общее уравнение диссоциации комплексного иона имеет вид
[PbCl4]2- ↔ 2Cl- + PbCl2↓
Реакции диссоциации тетратиосульфатоплюмбат (II) калия
K6[Pb(S2O3)4] ↔ 6К+ + [Pb(S2O3)4]6-
[Pb(S2O3)4]6- ↔ S2O32- + [Pb(S2O3)3]4-
[Pb(S2O3)3]4-↔ S2O32- + [Pb(S2O3)2]2-
[Pb(S2O3)2]2-↔ S2O32- + PbS2O3↓
Общее уравнение диссоциации комплексного иона имеет вид
K6[Pb(S2O3)4] ↔ 3S2O32- + PbS2O3↓
г) Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, выражение константы нестойкости для тетрахлороплюмбат-иона будет иметь вид

выражение константы нестойкости для тетратиосульфатоплюмбат-иона будет иметь вид

Контрольное задание №9
Кислотно-основное титрование
Задача 9.1.
Вычислить, сколько мл 70% раствора серной кислоты с плотностью 1,611 г/см3 необходимо взять для приготовления 20,0 л 0,10 н. раствора.
Решение:
При решении задач подобного типа необходимо учитывать, что массы веществ в концентрированном и разбавленном растворах равны между собой.
|
|
|
mв-ва в конц. р-ре = mв-ва в разб. р-ре
1. Рассчитаем массу H2SO4, необходимую для приготовления разбавленного раствора объемом 20,0 л с концентрацией 0,10 н . Из формулы для расчёта эквивалентной концентрации раствора (Сн)
Сн =  , где
, где
m – масса растворённого вещества, г;
Mэкв – эквивалентная масса, г;
V – объём раствора, л.
вычислим массу серной кислоты:
m(H2SO4) = Сн × Мэкв(H2SO4) × V = 0,10 × 49,03 × 20,0 = 98,06 (г)
Мэкв(H2SO4) =  × m(H2SO4) =
× m(H2SO4) =  × 98,06 = 49,03
× 98,06 = 49,03 
2. Из формул для расчета массовой доли вещества:
ω=  · 100% , находим массу концентрированного раствора серной кислоты.
· 100% , находим массу концентрированного раствора серной кислоты.
m р-ра (H2SO4) =  =
=  = 140,09 г.
= 140,09 г.
3. Находим объем концентрированного раствора серной кислоты:
V(H2SO4) =  =
=  = 86,96 мл
= 86,96 мл
Задача 9.2.
Вычислить, сколько граммов NaOH содержится в 0,5 л раствора, если на титрование 10,0 мл этого раствора израсходовано 8,20 мл раствора H2SO4, титр которого равен 0,04407 
Решение.
1. Уравнение реакции: 2NaOH + H2SO4 → Na2SO4 + H2O
По уравнению реакции определим факторы эквивалентности реагирующих веществ:
 (H2SO4) =
(H2SO4) =  ;
;  (NaOH) =
(NaOH) = 
2. Вычислим нормальную концентрацию раствора H2SO4 по формуле:
С  (H2SO4) =
(H2SO4) = 
так как Т =  ,
,
то m(H2SO4) = T(H2SO4) 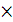 V(H2SO4),
V(H2SO4),
тогда
С  (H2SO4) =
(H2SO4) =  =
=  ,
,
где 1000 – коэффициент пересчёта миллилитров в литры.
|
|
|
С  (H2SO4) =
(H2SO4) =  = 0,8988 н
= 0,8988 н
2. По закону эквивалентов:
n  (H2SO4) = n(NaOH)
(H2SO4) = n(NaOH)
С  (H2SO4)
(H2SO4) 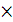 V(H2SO4) = С(NaOH)
V(H2SO4) = С(NaOH) 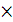 V(NaOH)
V(NaOH)
С(NaOH) =  =
=  = 0,7370 н
= 0,7370 н
3. Рассчитаем массу NaOH, содержащегося в 0,5 л раствора по формуле:
m(NaOH) =  =
= 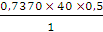 = 14,74 г
= 14,74 г
Контрольное задание №10
Дата добавления: 2018-06-01; просмотров: 1140; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
