Диагностическая торакоскопия.
Часто основной целью торакального хирурга при обследовании больного с новообразованием средостения является получение достаточного количества материала для гистологического исследования. В тех случаях, когда игловая биопсия небезопасна или малоинформативна в дело вступает торакоскопия. Использование торакоскопической техники позволяет произвести биопсию лимфатических узлов большей части переднего и заднего средостения. При наличии больших нерезектабельных образований средостения с помощью торакоскопии можно оценить состояние окружающих органов и произвести надежную биопсию, практически на 100% разрешив вопрос о гистологическом строении опухоли. Именно эти, близкие к 100%, точность, чувствительность и специфичность торакоскопии делают ее методом выбора при диагностике новообразований средостения. Кроме того, при видеоторакоскопии можно удалить доброкачественные опухоли и кисты средостения. Опыт подобных операций в мире растет, имеют его и российские клиники. На сегодняшний день видеоторакоскопию как основной метод хирургического лечения неосложненных кист средостения, неинвазивных опухолей средостения размерами до 6-8 см. Также торакоскопическая тимэктомия успешно вытесняет открытые доступы при удалении гиперплазированной вилочковой железы у больных аутоиммунной миастенией. Таким образом, торакоскопия при образованиях средостения может рассматриваться и как диагностическая и как лечебная процедура.
|
|
|
С началом широкого применения торакоскопии другие инвазивные методы исследования при образованиях средостения в значительной степени отошли на второй план. потеряли свою актуальность.Медиастиноскопия при новообразованиях средостения в настоящее время используется довольно редко и не в своем классическом виде, описанном Карленсом, а чаще, как парастернальная медиастиноскопия. Открытые способы биопсии образований средостения применяются еще реже. По сути,, а открытая биопсия средостения (медиастинотомия по Чемберлену) сохранила свою актуальность в случаях синдрома верхней полой вены, когда общая анестезия не желательна или невозможна, а также в клиниках, где нет возможности воспользоваться эндоскопической техникой.– практически вообще не используется. Помягче надо, тем более, что есть разные медиастиноскопии (вспомни Мотуса)
ЛЕЧЕНИЕ НОВООБРАЗОВАНИЙ СРЕДОСТЕНИЯ.
Для лечения новообразований средостения используются различные методы, ключевым из которых является – хирургический. При любом инкапсулированном образовании средостения больному показано его хирургическое удаление. Даже при кистах или явно доброкачественных опухолях их наблюдение следует признать ошибкой, поскольку компрессионные синдромы развиваются вне зависимости от гистологической природы образования.
|
|
|
При нерезектабильных образованиях средостения используются химио-лучевая терапия в зависимости от гистологического строения и степени распространенности опухоли. Конкретные показания и выбор метода лечения мы обсудим в разделе, посвященном отдельным видам новообразования средостения.
ОТДЕЛЬНЫЕ ВИДЫ НОВООБРАЗОВАНИЙ СРЕДОСТЕНИЯ.
ОБРАЗОВАНИЯ ВИЛОЧКОВОЙ ЖЕЛЕЗЫ.
Среди заболеваний поражающих вилочковую железу встречаются тимомы, тимолипомы, кисты тимуса, нейроэндокринные опухоли и рак тимуса. Кроме того, тимус, как лимфоидный орган может быть мишенью для метастатического поражения при раке других органов или при лимфомах.
Тимомы являются самыми частыми опухолями переднего средостения, составляя примерно 23-27% от всех новообразований. Пик заболеваемости тимомами приходится на 40-50 летний возраст, при этом мужчины и женщины заболевают одинаково часто. У детей тимомы встречаются исключительно редко.
В момент диагностики примерно одна треть пациентов не предъявляет никаких жалоб. Симптомы при тимомах могут быть связаны либо с компрессией окружающих тканей, либо с системными проявлениями в виде паранеопластических синдромов. Наиболее известным системным паранеопластическим синдромом при тимомах является миастения. Она встречается у 30-40% больных с тимомами. Аутоиммунный характер такого сочетания болезней подтверждается выявлением у больных тимомами высокого титра антител к ацетилхолиновым рецепторам и скелетным мышцам. С другой стороны, примерно у 10- 15% всех больных страдающих миастенией при обследовании выявляется тимома, а еще у 50-60% гиперплазия вилочковой железы. Следует отметить, что течение миастении у больных тимомой отличается худшим прогнозом, хуже поддается консервативному лечению, и дает худшие результаты при тимэктомии. Реже при тимомах встречаются гипогаммаглобулинемия и аплазия красного костного мозга (от 3 до 15%). Кроме того, у больных тимомами могут выявляться дерматомиозит, системная красная волчанка, апластическая анемия, ревматоидный артрит и другие аутоиммунные заболевания.
|
|
|
При тимомах чаще поражается левая доля вилочковой железы, поэтому чаще тимомы располагаются слева от средней линии. Рентгенологически опухоль может сохранить форму вилочковой железы, либо представлять собой округлое образование, расположенное в преваскулярном отделе средостения, между грудиной и дугой аорты. При компьютерной томографии хорошо определяется положение образования, его отношение с окружающими тканями. При тимомах могут выявляться кальцинаты в ткани вилочковой железы, что является довольно типичным признаком.
|
|
|
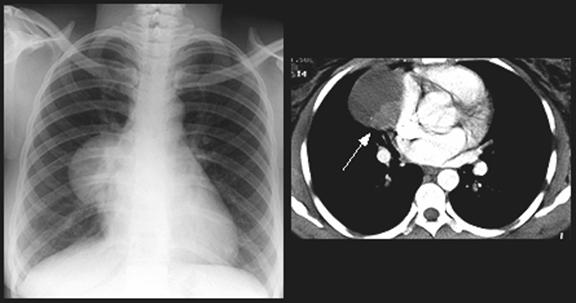
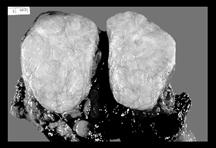
Рисунок 3. Рентгенограмма компьютерная томограмма и операционный препарат больного с тимомой.
Для гистологической классификации тимом было предложено множество разнообразных схем, однако в настоящее время в мире используется гистологическая классификации ВОЗ (таблица 6). Эта классификация разделяет все тимомы на три большие группы: 1) доброкачественные, 2) злокачественные 1 степени прогрессии, 3) злокачественные 2 степени прогрессии. Эта гистологическое деление позволяет определить лечебную тактику и прогноз пациентов.
Таблица 6. классификация органоспецифических опухолей вилочковой железы (ВОЗ)
| Доброкачественные тимомы | |
| А | Медуллярно-клеточная дифференцировка |
| АВ | Смешанноклеточная (кортико-медуллярная) дифференцировка |
| Злокачественные тимомы I категории | |
| В1 | Преимущественно кортикально-клеточная дифференцировка |
| В2 | Светлоклеточные с кортикально-клеточной дифференцировкой |
| В3 | Высокодифференцированный рак тимуса |
| Злокачественные тимомы II категории | |
| С
| Плоскоклеточный ороговевающий рак |
| Плоскоклеточный неороговевающий рак | |
| Лимфоэпителиоидный рак | |
| Саркоматоидная карцинома карциносаркома) | |
| Светлоклеточный рак | |
| Базальноклеточный рак | |
| Мукоэпидермоидный рак | |
| Недифференцированный рак | |
Однако уникальность тимом заключается в том, что даже доброкачественные по гистологическому строению опухоли могут иметь инвазивный характер роста. Таким образом, важной характеристикой тимомы является также степень инвазии ее в капсулу, окружающую клетчатку и ткани, для оценки которой используется классификация Masaoka (таблица 7).
Таблица 7. Стадия прогрессии (инвазии) тимом по Masaoka. (Masaoka A., Monden Y. // Cancer.-1981; V48, pp 2485-92)
| Стадия | Описание критериев диагностики стадии |
| I | Макроскопически полностью инкапсулированная опухоль без инвазии капсулы при микроскопии; |
| II | a. Макроскопическая инвазия опухоли в капсулу, окружающую жировую клетчатку и /или медиастинальную плевру; |
| b. Микроскопическая инвазия опухоли в капсулу; | |
| III | Инвазия элементов опухоли в прилежащие органы: легкое, перикард, крупные сосуды; |
| IV | a. Плевральная или перикардиальная диссеминация опухоли; |
| b. Лимфогенные и гематогенные метастазы; |
Для определения степени инвазии до операции могут использоваться как КТ так и МРТ. Кроме того, для диагностики тимом в последние годы используется однофотонная эмиссионная КТ с октреотидом. Хочется еще раз напомнить, что применение трансторакальной биопсии при инкапсулированных неинвазивных тимомах является ошибкой, потому что лечение в таких случаях должно начинаться с радикальной операции вне зависимости от гистологической структуры опухоли.
Для удаления опухоли чаще используют срединную стернотомию, реже торакотомию, а при маленьких хорошо инкапсулированных опухолях – торакоскопию. Около 50-60% всех тимом являются доброкачественными и требуют только хирургического лечения. При выявлении инвазии в окружающие органы и ткани больным проводят лучевую терапию, а при наличии лимфогенных или гематогенных метастазов – химиотерапию. Нерезектабельные опухоли тимуса можно подвергнуть химио- и лучевой терапии. Поскольку радиочувствительность тимом достаточно велика, такое лечение позволяет значительно продлить жизнь и улучшить ее качество у больных со злокачественными инвазивными тимомами.
Пятилетняя выживаемость больных с тимомами составляет для 1-2 стадии 90%, для 3 стадии 60% для 4 стадии – менее 25%
Первичные нейроэндокринные раки тимуса, ранее известные как карциноиды тимуса, составляют менее 5% всех опухолей переднего средостения. Этот тип карциномы обычно поражает мужчин в возрасте 40-60 лет и гораздо более агрессивен, чем нейроэндокринные опухоли других локализаций. Первичные нейроэндокринные карциномы тимуса могут протекать бессимптомно или проявляться признаками местной инвазии. Приблизительно 50% пациентов имеют различную эндокринную патологию: наиболее часто синдром Кушинга, связанный с эктопической продукцией АКТГ, или синдром множественной эндокринной неоплазией. Типичный карциноидный синдром при нейроэндокринных карциномах тимуса встречается гораздо реже. В большинстве случаев при дальнейшем течении заболевании у больных появляется метастазы в лимфатические узлы и отдаленные метастазы, включая остеобластические метастазы в кости.
Полная хирургическая резекция является методом выбора, в то время как адьювантная химиотерапия не дает однозначно положительных результатов. Последние годы в экспериментах на животных изучаются лечебные возможности радионуклидной терапии для опухолей с наличием соматостатиновых рецепторов. Возможно, этот метод вскоре найдет свое клиническое применение. При карциномах тимуса пяти- и десятилетняя выживаемость составляет соответственно 27 и 10%.
Кисты тимуса могут быть как врожденными, так и приобретенными. Строго говоря, приобретенные кисты тимуса являются последствиями либо распада в опухоли тимуса либо следствием воспалительных процессов в вилочковой железе (чаще аутоиммунных). При первичных кистах тимуса они имеют гладкие стенки, в которых обнаруживаются элементы вилочковой железы. Поскольку окончательная диагностика кист тимуса возможна только после гистологического исследования препарата, основным методом лечения является их хирургическое удаление. Лучше всего провести эту операцию при помощи видеоторакоскопии. Рецидивы в литературе не описаны, поэтому прогноз при кистах тимуса благоприятный.
НЕЙРОГЕННЫЕ ОПУХОЛИ
Нейрогенные опухоли могут развиваться из межреберных нервов или симпатических ганглиев, и, в связи со своей анатомической локализацией, чаще всего определяются в заднем средостении или паравертебральных желобах (рисунок 4).
Исключение может могут составлять опухоли исходящие из диафрагмального нерва, которые, соответственно, будут располагаться в переднем висцеральном или преваскулярном средостении. Нейрогенные опухоли чаще встречаются у взрослых старше 25-30 лет. Поскольку всего лишь 10-12% неврогенных опухолей средостения у взрослых являются злокачественными, чаще всего они обнаруживаются как «случайная находка» при профилактических флюорографических осмотрах. У детей злокачественные нейрогенные опухоли встречаются гораздо чаще (до 40%).
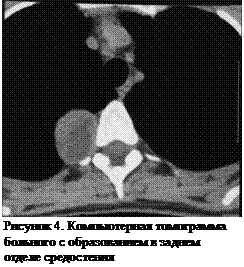 Наиболее частым симптомом является боль в грудной клетке, связанная с компрессией нерва или пролежнем надкостницы, если опухоль расположена близко к ребру или позвонку. Признаки компрессии спинного мозга при нейрогенных опухолях встречаются нечасто, и характерны для опухолей типа «песочных часов», распространяющиеся в спинномозговой канал через межпозвонковоеочное отверстие. Некоторые нейрогенные опухоли у детей обладают гормональной активностью, что является также одним из признаков злокачественности для нейрогенной опухоли. Эктопическая продукция гормонов из таких опухолей может приводить к развитию диареи, гипертензии, лихорадки, «приливов к лицу». Выделяют следующие гистологические типы нейрогенных опухолей:
Наиболее частым симптомом является боль в грудной клетке, связанная с компрессией нерва или пролежнем надкостницы, если опухоль расположена близко к ребру или позвонку. Признаки компрессии спинного мозга при нейрогенных опухолях встречаются нечасто, и характерны для опухолей типа «песочных часов», распространяющиеся в спинномозговой канал через межпозвонковоеочное отверстие. Некоторые нейрогенные опухоли у детей обладают гормональной активностью, что является также одним из признаков злокачественности для нейрогенной опухоли. Эктопическая продукция гормонов из таких опухолей может приводить к развитию диареи, гипертензии, лихорадки, «приливов к лицу». Выделяют следующие гистологические типы нейрогенных опухолей:
Шваннома. Опухоли, исходящиея из оболочки нервных стволов. Составляет от 40 до 60 % всех нейрогенных опухолей. Они происходят из зрелых шванновских клеток межреберных нервов и представляют собой плотные желтоватые, хорошо инкапсулированные образования, почти всегда доброкачественные. Распространение по типу «песочных часов» характерно именно для этих опухолей. Эти образования могут вырастать до относительно больших размеров. При операции можно обнаружить их связь с межреберным нервом или корешком.
Лечение этого вида неврином – оперативное. Для выбора метода операции имеет значение, есть ли распространение опухоли в позвоночный канал. При простой шванноме предпочтительным хирургическим доступом является видеоторакоскопия. Если у больного опухоль по типу «песочных часов», необходима открытая операция с участием нейрохирургов в ходе которой будет устранена компрессия спинного мозга. Если этого не сделать у больного не пройдут симптомы заболевания, и будет продолжаться рост опухоли. При правильно выполненной операции прогноз благоприятный
Нейрофиброма содержит элементы, как нервных оболочек, так и нейроны, и составляет около 10 % от всех нейрогенных опухолей. Капсула нейрофибром выражена недостаточно четко. Однако при рентгеновском исследовании они могут напоминать шванному. Нейрофибромы средостения могут являться одним из проявлений генерализованного нейрофиброматоза (Болезнь Реклинхаузена, тип II). В таких случаях риск их малигнизации до нейросаркомы возрастает. Кроме того, с возрастом также увеличивается риск малигнизации нейрофибромы. Вообще, 25-30 % опухолей этого типа бывают злокачественными, и в таких случаях сопровождаются быстрым агрессивным ростом и плохим прогнозом. Лечение – хирургическое. Предпочтительный метод операции – видеоторакоскопия, однако, при малейших сомнениях в доброкачественности образования операция следует перевести в открытую.
Нейробластома является наиболее низко дифференцированной опухолью, происходящей из симпатической нервной системы. Лишь 10% из них проявляется первичным поражением средостения, более чем 75% встречаются у детей в возрасте до 4 лет, большинство – гормонально активны и продуцируют ванилин-миндалевую кислоту, в количествах, достаточных для появления системного симптомокомплекса. Он часто включает в себя гипертензию, лихорадку, рвоту и диарею. На момент диагностики нередко выявляются метастазы в кости, печень, лимфатические узлы, а также признаки прямой инвазии в спинной мозг. На таких стадиях опухоль, как правило, уже нерезектабельна, однако она хорошо чувствительна к лучевой терапии. Благоприятным фактором является первичное поражение средостения, и проявления в возрасте до года.
Ганглионеврома происходит из зрелых нервных клеток симпатического ганглия и является доброкачественной опухолью. Они встречаются у более молодых пациентов, по сравнению со шванномами. Рентгенологически ганглионеврома имеет треугольную форму, с основанием, обращенным к средостению. Обычно капсула у них выражена недостаточно хорошо, и при резекции возникают трудности, связанные с адгезией с окружающими тканями.
Ганглионейробластомы состоят как из зрелых, так и незрелых клеток, имеют склонность к инвазивному росту. У взрослых пациентов встречаются редко, чаще поражают детей в возрасте до 3 лет.
Параганглионарные опухолиразвиваются из клеток симпатической нервной системы, поэтому часто содержат элементы нейроэндокринной ткани (клетки APUD-системы).
Феохромацитома является типичным представителем параганглионарыных опухолей, отличается синтезом катехоламинов. В сСредостениеи как первичная локализации встречается чуть более 1% от всех феохромацитом. Также как и при других вненадпочечниковых локализациях, средостенные феохромацитомы опухоли, как правило, молчащиекак правило гормоно (несекретирующие), однако чаще являются более злокачественными впо сравнен сравнении сию с адреналовыми феохромациотомами.
Хемеодектомыявляются нехромофинными параганглионарными опухолями, которые секретируют катехоламины, и происходят из хеморецепторов, расположенных вокруг дуги аорты и блуждающего нерва. Они встречаются достаточно редко. 15-20% из них злокачественными. Резектабильные опухоли должны подвергаться хирургическому удалению. При нерезектабильности проводят химио-лучевую терапию
ЛИМФОМЫ.
Большинством терапевтов лимфома воспринимается как диффузное заболевание, поражающее всю лимфоидную ткань организма или даже как одна из разновидностей лимфолейкоза. Действительно, у многих больных с диффузными лимфомами выявляется поражение лимфатических узлов средостении. Однако приблизительно у 5-10% больных с лимфомами средостение является первым местом проявления заболевания или вообще единственным. Изолированная медиастинальная форма лимфом встречается у 1/5 части больных новообразованиями средостения и является второй по частоте опухолью переднего средостения у взрослых. Несмотря на то, что переднее средостение является типичными местом локализации лимфом, они могут располагаться и в висцеральном и, иногда, даже в заднем средостении. Кроме того, учитывая склонность к быстрому инвазивному росту и относительную узость пространства, в отдельных случаях опухолевый конгломерат может занимать весь верхний отдел средостения от грудины до позвоночного столба (рисунок 5).
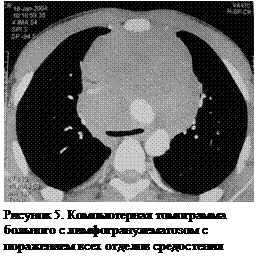 Что касается гистологической структуры, то в средостении могут встречаться морфологически любые виды лимфом. Однако, чаще всего среди медиастинальных лимфом обнаруживаются три гистологических типа: лимфогранулематоз (болезнь Ходжкина), диффузная В-клеточная лимфома и лимфобластная лимфома. Лимфогранулематоз значительно доминирует и выявляется более чем у 60% среди всех больных с изолированной медиастинальной формой лимфомы.
Что касается гистологической структуры, то в средостении могут встречаться морфологически любые виды лимфом. Однако, чаще всего среди медиастинальных лимфом обнаруживаются три гистологических типа: лимфогранулематоз (болезнь Ходжкина), диффузная В-клеточная лимфома и лимфобластная лимфома. Лимфогранулематоз значительно доминирует и выявляется более чем у 60% среди всех больных с изолированной медиастинальной формой лимфомы.
Лимфогранулематоз (болезнь Ходжкина) встречается чаще у молодых женщин в возрасте от 20 до 40 лет, может вовлекать не только лимфоузлы переднего средостения, но и другие лимфоидные органы, в частности вилочковую железу. Учитывая быстроты роста и метаболическую аквтиность заболевание сопровождается компрессионными синдромами (синдромом верхней полой вены, боль), общими симптомами (лихорадка, похудание, кожный зуд). Тем не менее, на начальных стадиях развития лимфогранулематоза бессимптомное течение встречается гораздо чаще, чем принято считать.
Наиболее частым гистологическим подтипом болезни Ходжкина в средостении является нодулярный склероз, однако встречаются и три другие гистологических подтипа лимфогранулематоза.
Диффузная В-клеточная лимфома является второй по частоте изолированной лимфомой средостения, встречаясь в средостении чаще других неходжкинских лимфом. Для В-клеточных лимфом отмечается интересное бимодальное распределение заболеваемости по возрастам. Первый пик заболеваемости приходится на возраст от 33 до 39 лет, причем женщины заболевают в два раза чаще, и опухоль чаще поражает переднее средостение. Второй возрастной пик отмечается в 65 лет, когда опухоль чаще поражает мужчин и располагается в заднем средостении. Опухоль характеризуется довольно быстрым ростом, поэтому рано проявляется разнообразными компрессионными симптомами. В-клеточная лимфома не редко сопровождается внемедиастинальным поражением. Опухоль может вовлекать внутрибрюшные лимфоузлы, почки, надпочечники, печень. Кроме того, может отмечаться поражение легких, перикарда, плевры.
Лимфобластная лимфома в высшей степени агрессивная опухоль чаще встречается у детей и подростков, хотя, теоретически может выявляться в любом возрасте. Мужчины болеют несколько чаще. Поражение органов и лимфоузлов брюшной полости при этом виде лимфомы встречаются достаточно редко, зато часто поражается ЦНС, периферические нервы. Кроме того, исключительно характерным для лимфобластных лимфом является поражение костного мозга (лейкемизация) с развитием клинических и гематологических признаков острого лимфобластного лейкоза.
Несмотря на довольно яркую клиническую картину и наличие полициклической массивной тени в верхнем отделе средостения диагностика лимфом не должна быть основана только на клинико-рентенологических данных. Принципиально важным для выбора метода лечения является получение достаточного участка патологической ткани для гистологического и иммуногистохимического исследования. Поскольку лимфомы являются нерезектабильными опухолями как в силу их гистологических особенностей, так и в силу быстрого инвазивного роста главной задачей хирурга при лимфоме является надежная гистологическая верификация диагноза с минимальной травмой для больного. Так при наличии увеличенных периферических лимфоузлов инвазивную диагностику часто начинают с их биопсии. Если это не позволяет верифицировать диагноз, выполняется торакоскопия или медиастинотомия. При этом производится биопсия непосредственно медиастинальной опухоли, оценивается истинная распространенность опухоли и при необходимости, произвоится дополнительная биопсия других вовлеченных в процесс внутригрудных органов. В отдельных центрах пользуются трансторакальной игловой биопсией, однако дальнейшая обработка материала требует использования иммуногистохимического исследования, трудноприменимого для цитологического материала. Большинство торакальных центров сходится во мнении, что тонкоигольная аспирационная биопсия при лимфоретикулярных опухолях средостения не достаточно информативна для назначения окончательного лечения.
Лечение лимфом заключается в проведении химиолучевой терапии. В течение последних 20 лет результаты лечения ходжкинских лимфом значительно улучшились, и на сегодняшний день 5-летняя выживаемость при лечении лимфогранулематоза достигает 75%. Для оценки эффективности терапии используют МРТ, сцинтиографию с галлием и ПЭТ. Особенно эти исследования ценны при дифференциальной диагностике остаточной опухоли и рубцовой ткани в средостении. В противоположность болезни Ходжкина при неходжкинских лимфомах прогноз остается менее благоприятным. Медиана выживаемости при этих лимфомах составляет всего 13 месяцев несмотря на агрессивную химиолучевую терапию. Несколько лучше прогноз при крупноклеточной лимфоме.
В заключении этого раздела хотелось бы коснуться хирургического лечения лимфом. Поскольку опухоли из лимфоретикулярной ткани часто являются системным заболеванием и практически всегда обладают инвазивным ростом, их хирургическое лечение не рекомендуется. Попытки резекции лимфом чаще всего происходят, когда их принимают за другие опухоли переднего средостения. В частности, это относится к лимфогранулематозу тимуса, который принимают до операции за инвазивную тимому. В таком случае удаление опухоли не ухудшает выживаемости больных, но не избавляет их от необходимости получать химио- и лучевую терапию.
ГЕРМИНОГЕННЫЕ ОПУХОЛИ.
В отечественной и зарубежной литературе этот вид новообразований средостения имеет весьма противоречивые описания и классификации. По современным представлениям под этим термином объединяются различные опухоли, возникающие из примитивных полипотентных зародышевых клеток, которые мигрируют в средостение во время раннего эмбриогенеза.
Герминогенные опухоли составляют до 15% у взрослых и 25% у детей с образованиями средостения. Опухоли практически всегда располагаются в переднем средостении, хотя описаны казуистические случаи локализации герминогенных опухолей в заднем средостении.
Попытки классифицировать герминогенные опухоли на основании их злокачественности или зрелости не в достаточной степени отражают особенности их роста и недостаточны для назначения окончательного лечения. Современная классификация герминогенных опухолей средостения базируется на определении клеточного состава образования. Наиболее часто используемая классификация разделяет герминогенные опухоли на доброкачественные тератомы, семиномы и эмбриональные опухоли. Эмбриональные опухоли в свою очередь подразделяются на хорионкарциномы, опухоли желточного мешка, эмбриональный рак и тератокарциномы.
Таким образом, среди всех герминогенных опухолей только тератома может быть доброкачественной или злокачественной, остальные герминогенные опухоли всегда злокачественные. Как мы уже отмечали, обычно герминогенные образования располагаются в переднем средостении, и лишь около 8% - в заднем. Пик заболеваемости приходится на 20-30 летний возраст. Для злокачественных герминогенных опухолей характерно значительное преобладание мужчин, в то время как доброкачественными тератомами мужчины и женщины болеют одинаково часто или женщины даже несколько чаще. У детей герминогенные опухоли встречаются довольно часто, и, к сожалению, большая их часть – 90% представлена незрелой тератомой, эмбриональной карцинома и опухолью желточного мешка. Семинома и хорионкарцинома является более редкими гистологическими типами, доброкачественные тератомы – казуистическая редкость.
Тератомы составляют около 10% от всех опухолей средостения, и почти всегда располагаются в переднем (преваскулярном) или висцеральном отделе в висцерум компартмент средостенияи. По определению, тератомы состоят из множества разнообразных тканей, находящихся вне пределов своей обычной локализации.
Доброкачественные тератомы являются наиболее частой опухолью переднего средостения у детей. У взрослых тератомы встречаются одинаково часто среди мужчин и женщин в возрасте 20-40 лет. В средостении доброкачественные тератомы часто имеют жидкостный компонент и те из них, которые представляют собой однокамерное жидкостное образование, часто называют дермоидыми кистами.
Тератомы содержат как минимум 2 из 3 первичных зародышевых слоев: эктодерма, энтодерма и мезодерма.
Эктодермальные компоненты обычно преобладают и включают в себя кожу, волосы, потовые железы, сальные железы или зубы, причем элементы кожи встречаются более чем в 90% тератом. Мезодермальные компоненты включают жир, хрящевую и костную ткань, гладкие мышцы, а энтодермальные компоненты могут включать в себя респираторный или кишечный эпителий и ткань поджелудочной железы.
Доброкачественные тератомы состоят из зрелых тканевых элементов, чужеродных для области, где они обнаружены. Примерно 75% тератом содержат только зрелые клетки, без признаков нарушения дифференцировки и злокачественности. Однако у молодых людей после 15 лет тератомы могут иметь склонность к озлокачествлению, особенно если в их составе есть незрелые элементы. Изначально незрелые тератомы в предыдущие годы имели плохой прогноз, однако в настоящее время отдаленные результаты значительно улучшились благодаря агрессивной химиотерапии и расширенным резекциям.
Клинические проявления у 60% больных с доброкачественными тератомами отсутствуют и опухоли оказываются случайными находками. Среди клинических проявлений наиболее частыми являются компрессионные синдромы: боль, кашель, одышка, компрессия бронхов с развитием обтурационного пневмонита. При наличии в стенке элементов панкреатической ткани или других видов активно ферментирующих тканей может развиваться перфорация стенки кисты в окружающие ткани или прилежащие полые органы. Откашливание волос (трихофтиз) или содержимого, похожего на продукт сальных желез, является патогномоничным для доброкачественной тератомы и развивается в следствие пенетрации стенки тератомы в прилежащий бронх. Прорыв содержимого в перикард, сосудистые структуры или через кожу являются еще более редкими осложнениями, но более опасными. При томографическом исследовании определяется образование в проекции переднего средостения, неоднородное по плотности, содержащее жидкостные включения, элементы сала, жира, кальцинаты (рисунок 6). Изредка можно увидеть хорошо сформированные зубы или кости в проекции образования, и это является весьма характерным рентгенологическим признаком тератомы.
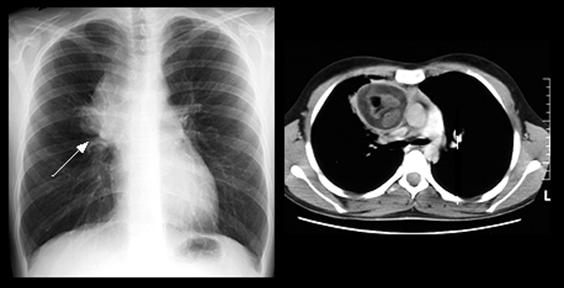

Рисунок 6. Рентгенограмма компьютерная томограмма и операционный препарат больного со зрелой тератомой.
Лечение тератом средостения заключается в их радикальном хирургическом удалении вне зависимости от наличия или отсутствия незрелых клеточных элементов в опухоли, поскольку малигнизация тератом описана у 25% больных. При опасности повреждения жизненно-важных органов при тератомах допустима частичная резекция опухоли для купирования компрессионных синдромов. Хирургический доступ при удалении тератомы зависит от ее локализации, размеров и предпочтений оперирующего хирурга. Однако, поскольку эти опухоли чаще локализуются в переднем средостении наиболее часто используемым доступом является срединная стернотомия. При уверенности в доброкачественности образования и небольших размерах опухоли можно выполнить операцию с помощью торакоскопии.
Семиномы. Первичные медиастинальные семиномы – редко встречающиеся опухоли, составляющие 2-4% среди опухолей средостения. Однако они составляют почти 50% всех злокачественных герминогенных опухолей средостения. Семиномы располагаются в переднем средостении и встречаются преимущественно у молодых мужчин в возрасте от 20 до 40 лет. У женщин семиномы встречаются гораздо реже и называются дисгерминомами.
Гистологически первичные семиномы средостения могут оказаться практически неотличимы от метастатического поражения средостения вследствие опухоли яичек. Безусловно, метастатическое поражение лимфатических узлов средостения при опухолях гениталий у мужчин практически не встречается без поражения забрюшинных лимфоузлов, и этот факт следует учитывать при дифференциальной диагностике этих состояний. Тем не менее, при выявлении семиномы средостения у всех молодых людей должно быть произведено тщательное обследование яичек. В диагностический алгоритм в таком случае следует включить осмотр, пальпацию и УЗИ мошонки, диафаноскопию, УЗИ малого таза.
Кроме того, следует помнить, что медиастинальные семиномы могут отличаться клеточной гетерогенностью и в них могут содержаться клеточные элементы эмбриональных злокачественных опухолей. Это может серьезно изменить прогноз течения и выбор метода лечения данных новообразований. Изложенное обстоятельство подчеркивает исключительную роль тщательного морфологического исследования и квалификации морфолога, работающего с торакальными хирургами, оперирующими опухоли средостения.
Чистые семиномы являются исключительно радиочувствительными опухолями, в то время как присутствие несеминомных герминогенных элементов не только ухудшает прогноз, но и изменяет радиочувствительность опухолей.
При семиномах чаще всего встречается боль и дискомфорт в грудной клетке. Другие общие симптомы: слабость, потеря веса, лихорадка, кашель гинекомастия встречаются реже. У 10% больных развивается синдром верхней полой вены.
Диагностика, как и при других образования средостения первоначально проводится по результатам лучевых методов визуализации. Для дальнейшей диагностики могут использоваться трансторакальная игловая биопсия и сывороточные маркеры. Правда, повышение уровня хорионического гоннадотропина описано лишь у 34% больных с семиномами, а уровень альфафетопротеина вообще должен оставаться нормальным. Повышение уровня указанных маркеров в высшей степени характерно для несеминомных герминогенных опухолей. Обязательным элементом обследования больных с семиномами является поиск отдаленных метастазов. При этом стандартным требованием является исследование забрюшинных лимфоузлов с помощью КТ и сцинтиграфия всего тела с галлием, поскольку семиномы хорошо накапливают галлий.
Лучевая терапия является методом выбора лечения семином средостения без метастазов. Использование наружного облучения в дозе 50 Гр на область средостения, шеи и надключичных областей полностью излечивает от 40 до 96% больных. При обширном поражении средостения попытки хирургического уменьшения объема опухоли не улучшают прогноз заболевания в сравнении с лучевой терапией, поэтому не рекомендованы большинством торакальных хирургов. Хирургическое лечение используется при удалении резидуальной опухолевой массы после химиотерапии. При небольших инкапсулированных образованиях лечение может начинаться с хирургической резекции со всей окружающей клетчаткой. Однако несмотря на радикальность выполненной операции в послеоперационном периоде также рекомендуется использование лучевой терапии.
Герминогенные несеминомные опухоли как правило описывают вместе вследствие принципальной схожести их клинической картины, схем лечения и прогноза.
Эмбриональная карцинома, хорионкарцинома и опухоль желточного мешка составляют от 1 до 3,5% всех опухолей средостения. Эти опухоли чаще встречаются у молодых мужчин, в отношении к женщинам примерно 4:1. Поскольку эти опухоли являются в высшей степени злокачественными, неудивительно, что 80% из них сопровождается разнообразными симптомами. Очень часто при несеминомных герминогенных опухолях встречается инвазия окружающих средостенных структур, грудной стенки, грудины. Нередки и компрессионные синдромы (синдром верхней полой вены, сдавление диафрагмального нерва, сдавление трахеи и т.д.). Довольно часто встречается лихорадка, слабость, потеря аппетита и веса, повышение СОЭ, лейкоцитоз. Характерными являются не только компрессионные синдромы, но и эктопическая продукция различных биологически активных веществ.
Классическими опухолевыми маркерами для герминогенных опухолей является повышение уровня хорионического гонадотропина человека (ХГЧ), особенно его b-фракции. Кроме того, герминогенные опухоли могут продуцировать a-фетопротеин (АФП), который такжеоже используется как опухолевый маркер. Эти биологические субстанции повышаются не в разы, а в сотни и даже тысячи раз в сравнении с нормой. Повышение уровня ХГЧ и АФП в сочетании с наличием образования в переднем средостении, по мнению ряда хирургов, являются достаточными аргументами для постановки диагноза «герминогенная несеминомная опухоль средостения» и назначения химиотерапии без какой-либо дополнительной верификации диагноза.
Повышение уровня ХГЧ, особенно его b-субъединицы, вызывает стимуляцию продукции ТТГ и может приводить развитию тиреотоксикоза. На этом основании следует рекомендовать определения уровня ХГЧ и КТ грудной клетки при тиреотоксикозе у молодых мужчин. Первичные несеминомные герминогенныей опухоли часто выявляются у больных с синдромом Кляйнфельтера и ассоциируются с более высоким риском развития гематологических опухолей, плохо поддающихся лечению.
Лечение герминогенных опухолей в настоящее время рекомендовано начинать с неоадьювантой химиотерапии. В силу своих гистологических свойств герминогенные опухоли обладают высокой химиочувствительностью. Хирургическая резекция может быть предпринята, если после химиотерапии имеется остаточная опухолевая масса. Прогноз зависит от чувствительности к первоначальной химиотерапии. В последние десять лет, выживаемость у таких пациентов значительно улучшилась.
КИСТЫ СРЕДОСТЕНИЯ
Врожденные кисты составляют примерно 20% всех образований средостения. Располагаются они чаще в среднем или заднем средостении. На рентгенограмме грудной клетки они выглядят как плотные новообразования средостения. Однако при КТ средостения отчетливо определяется жидкостная плотность. Кроме того, учитывая особенности визуализации, . Иидеальным способом диагностики кист средостения является МРТ.
Кисты перикарда.Этот вид кист наиболее часто встречается в средостении. Чаще всего киста перикарда встречается как случайная находка без каких-либо симптомов и представляет собой округлое жидкостное образование в правом реберно-диафрагмальном углу. Перикардиальные кисты обычно содержать прозрачную жидкость и иногда сообщаются с полостью перикарда. Гистологически в них определяется однорядная выстилка из мезотелиальных клеток мезотелия. Внешний вид при КТ и локализации кист перикарда столь характерны, что диагноз практически не вызывает сомнения. Эффективным методом диагностики кист перикарда является эхокардиография. Ряд авторов считает, что уУчитывая их клиническое поведение (без малигнизации и нагноения) возможно динамическое наблюдение. Основываясь на собственном опыте, можем сказать, что зачастую кисты перикарда являются причинами неприятных симптомов и нарушений сердечного ритма. Современные возможности видеоторокоскопии позволяют удалить их с минимальной физической и косметической травмой для больного, поэтому мы рекомендуем их оперативное лечение.
Бронхогенные кисты чаще всего локализуются кзади от бифуркации трахеи. Сообщение СА с трахеобронхиальным деревом встречается крайне редко. Их локализация позволяет легко дифференцировать их от перикардиальных кист, Однако иногда требуется дифференциальная диагностика бронхогенной кисты с абсцессом или кистой легкого. Внутренняя выстилка кисты состоит из реснитчатого респираторного эпителия, а сама стенка может содержать некоторое количество хрящевой ткани, гладких мышц и бронхиальных желез (рисунок 7).
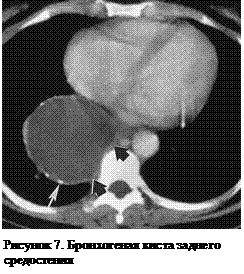 У детей бронхогенные кисты часто вызывают разнообразные компрессионные синдромы. Все бронхогенные кисты должны подвергаться хирургической резекции, поскольку в литературе описаны случаи их нагноения. Наилучший метод хирургического лечения – видеоторакоскопия.
У детей бронхогенные кисты часто вызывают разнообразные компрессионные синдромы. Все бронхогенные кисты должны подвергаться хирургической резекции, поскольку в литературе описаны случаи их нагноения. Наилучший метод хирургического лечения – видеоторакоскопия.
Энтерогенные кисты локализуются в заднем средостении рядом с пищеводом. Иногда они могут находиться внутри мышечной стенки пищевода, но практически никогда не сообщаются с его просветом. В энтерогенных кистах встречается как кишечный, так и желудочный эпителий. Наличие желудочного эпителия в кисте, делает пенетрацию и нагноение более вероятными. Примерно 60% всех энтерогенных кист диагностируются у детей в возрасте до 1 года. В старшем возрасте энтерогенные кисты редко вызывают какие-либо симптомы, поэтому чаще являются случайной находкой. Лечение, как и при бронхогенных кистах, заключается в их хирургическом удалении. Оперативное вмешательство легко может быть выполнено при помощи видеоторакоскопии.
Заключение
Вы познакомились с одним из наиболее интересных разделов торакальной хирургии. Средостение как анатомическая область до предела насыщена жизненно-важными органами и структурами. При этом возможные виды новообразований средостения также исключительно разнообразны как по гистологическому происхождению, так и по расположению в средостении.
Для современного хирургического лечения больных с объемными процессами в средостении клиницист должен иметь точный диагноз во всех случаях, включая больных с внешне доброкачественными изменениями по стандартным рентгенограммам и КТ.
В тех же случаях, когда хирургическое лечение образования в средостении представляется маловероятным, точная гистологическая диагностика является еще более важной задачей.
Иногда диагноз может быть получен с помощью простого метода. К сожалению, в большинстве случаев путь к диагнозу более длительный, сложный и затратный. Он требует тесного взаимодействия разных специалистов: торакального хирурга, рентгенолога, морфолога, невролога, терапевта.
Знание Вами принципов диагностики и лечения новообразования средостения будет очень полезным для Ваших будущих пациентов.
1. А.А. Вишневский, А.А. Адамян. Хирургия средостения / М. «Медицина», 1977.
2. Barnard SA, Cook CK. Causes of a widened mediastinum: a pictorial review.
Hosp Med. 2004 Sep;65(9):529-34.
3. Boaron M., Artuso S., Santelmo N. et al. Diagnosis and treatment of mediastinal lesion / W.S. Walker ed.– Video-assisted thoracic surgery. Oxford, UK: Isis Medical Media Ltd., 1999.– P. 67-82.
4. Dominguez Malagon H, Perez Montiel D. Mediastinal germ cell tumors. Semin Diagn Pathol. 2005 Aug;22(3):230-40.
5. Duwe BV, Sterman DH, Musani AI. Tumors of the mediastinum // Chest. 2005 Oct;128(4):2893-909.
6. Jaggers J, Balsara K. Mediastinal masses in children // Semin Thorac Cardiovasc Surg. 2004 Fall;16(3):201-8
7. Kim JH, Goo JM, Lee HJ et al. Cystic tumors in the anterior mediastinum. Radiologic-pathological correlation. // J Comput Assist Tomogr. 2003 Sep-Oct;27(5):714-23.
8. Macchiarini P, Ostertag H. Uncommon primary mediastinal tumours. // Lancet Oncol. 2004 Feb;5(2):107-18.
9. Pearson F.G: Thoracic Surgery (second edition), 2002
10. Savage KJ. Primary mediastinal large B-cell lymphoma. // Oncologist. 2006 May;11(5):488-95.
11. Shaham D, Skilakaki MG, Goitein O. Imaging of the mediastinum: applications for thoracic surgery. // Thorac Surg Clin. 2004 Feb;14(1):25-42.
12. Shields TW et al.: General Thoracic Surgery, 5th edition, V. 2 Lippincott Williams&Wilkins, 2004.
13. Shields T.W. Thymic tumors // T.W. Shields ed.– General Thoracic Surgery.– NY, 2000.– P. 2181-2205.
14. Tanaka O, Kiryu T, Hirose Y, et al. Neurogenic tumors of the mediastinum and chest wall: MR imaging appearance. // J Thorac Imaging. 2005 Nov;20(4):316-20.
15. Wick MR. Cystic lesions of the mediastinum. // Semin Diagn Pathol. 2005 Aug;22(3):241-53.
16. Wright C.D., Mathisen D.J. Mediastinal tumors: diagnosis and treatment // World J Surg.– 2001.– Vol.25, №2.– P. 204-209.
| |
Дата добавления: 2018-06-01; просмотров: 1213; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
