Температура. Равномерное распределение кинетической энергии по степеням свободы.
Температура – степень нагретости тела. Температура единственная величина, котороая обязательно одинакова во всех частях системы, находящейся в состоянии термодинамического равновесия.
Температура – макроскопическая характеристика термодинамических систем и для отельной молекулы смысла не имеет. С точки зрения молекулярно-кинетической теории абсолютная температура есть мера средней кинетической энергии поступательного движения частиц тела.
Измерение температуры производится косвенными методами, основанными на использовании таких свойств тела, которые могут быть измерены непосредственно. Тело, выбираемое для измерения температуры, называется термометрическим, а величина, используемая для изерения температуры – термометрической величиной.
Необходимо, чтобы температурная зависимость термометрической величины была близка к линейной, воспроизводимой и обеспечивала желаемую точность измерения. Этим требованиям удовлетворяет идеальный газ. На практике приходится использовать реальный газ, что вносит некоторую погрешность в измерение температуры.
В системе СИ введены 2 температурные шкалы: термодинамическая и международная практическая. При построении термодинамической шкалы используется единственная реперная точка – так называемая тройная точка воды. Эта точка соответствует термодинамическому равновесию системы, состоящей из льда, воды и водяного пара. Единица измерения температуры (1 Кельвин) выбирается так, чтобы температура тройной точки воды оказалась ровно на 273,16 К выше абсолютного нуля температуры.
Переход к температурам Цельсия (t) дается формулой: t = T – 273.15, при этом 1⁰С = 1 К.
Закон равномерного распределения энергии молекул идеального газа Больцмана: на каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия kT/2.
Таким образом, молекула с i-степенями свободы обладает средней кинетической энергией, равной:

Заметим, что при определении числа степеней свободы молекул газов принимаются во внимание те степени свободы, которые вносят существенный вклад в ее кинетическую энергию.
Классическая теория теплоемкости идеальных газов. Внутренняя энергия.
Так как молекулы идеального газа большую часть времени проводят на значительном удалении друг от друга, то можно пренебречь и силами, и энергией межмолекулярного взаимодействия. Отсюда следует важный вывод: внутренняя энергия идеального газа складывается только из кинетических энергий его атомов или молекул. Потенциальная составляющая внутренней энергии идеального газа оказывается равной нулю.
Количество теплоты, которое необходимо сообщить одному молю газа, чтобы увеличить его температуру на один градус, определяет молярную теплоемкость газа. c=δQ/mdT (Дж/(кг*К))
Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1К: C_m=δQ/νdT, где ν=m/M-количество вещества (Дж/(моль*К))
Внутренняя энергия U – энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц. Внутренняя энергия – однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние).
Билет. Основное уравнение молекулярно – кинетической теории. Уравнение идеального газа. Изопроцессы.
Основное уравнение молекулярно-кинетической теории идеального газа устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
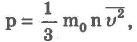
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы

можно записать:
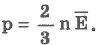
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT
где n – число молей газа;
P – давление газа (например, в атм;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм/моль·K).
Изопроцессы — равновесные процессы, в которых один из основных параметров сохраняется.
ИЗОБАРНЫЙ ПРОЦЕСС- термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа. (  ) Для изобарного процесса в идеальном газе справедлив закон Гей-Люссака: при постоянном давлении объем данной массы газа прямо пропорционален его термодинамической температуре:
) Для изобарного процесса в идеальном газе справедлив закон Гей-Люссака: при постоянном давлении объем данной массы газа прямо пропорционален его термодинамической температуре:  или
или  . Работа газа при изобарном расширении:
. Работа газа при изобарном расширении:  . Изменение внутренней энергии:
. Изменение внутренней энергии:  Количество полученного тепла в соответствии с первым началом термодинамики:
Количество полученного тепла в соответствии с первым началом термодинамики:  . Молярная теплоемкость при изобарном процессе:
. Молярная теплоемкость при изобарном процессе:  .
.
ИЗОХОРНЫЙ ПРОЦЕСС (  )-термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма. Изохорный процесс в идеальном газе описывается законом Шарля: при постоянном объеме давление данной массы газа прямо пропорционально его термодинамической температуре:
)-термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма. Изохорный процесс в идеальном газе описывается законом Шарля: при постоянном объеме давление данной массы газа прямо пропорционально его термодинамической температуре:  или
или  . Работа газа при изохорном процессе равна нулю:
. Работа газа при изохорном процессе равна нулю:  . Все полученное тепло идет на изменение внутренней энергии в соответствии с первым началом термодинамики:
. Все полученное тепло идет на изменение внутренней энергии в соответствии с первым началом термодинамики: 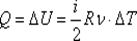 . Молярная теплоемкость при изохорном процессе:
. Молярная теплоемкость при изохорном процессе:  .
.
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС (  )-термодинамический процесс, происходящий в физической системе при постоянной температуре. Изотермический процесс в идеальном газе подчиняется закону Бойля - Мариотта: для данной массы газа при неизменной температуре произведение значений давления и объема есть величина постоянная:
)-термодинамический процесс, происходящий в физической системе при постоянной температуре. Изотермический процесс в идеальном газе подчиняется закону Бойля - Мариотта: для данной массы газа при неизменной температуре произведение значений давления и объема есть величина постоянная: 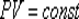 или
или  .
.
Работа газа при изотермическом расширении: 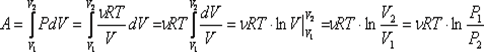 . Изменение внутренней энергии при изотермическом процессе равно нулю:
. Изменение внутренней энергии при изотермическом процессе равно нулю: 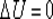 . Все полученное тепло идет на совершение работы в соответствии с первым началом термодинамики:
. Все полученное тепло идет на совершение работы в соответствии с первым началом термодинамики: 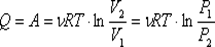 .
.
Дата добавления: 2018-06-27; просмотров: 371; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
