Глава 4. АТОМ ВОДНЮ В МОДЕЛІ БОРА
Постулати Бора
Великий датський фізик, лауреат Нобелівської премії Нільс Хендрик Давид Бор в 1913 році сформулював два постулати, які доповнили планетарну модель атома Резерфорда. При цьому була усунута основна перешкода при поясненні будови і властивостей атомів, яка полягала в тому, що модель Резерфорда не могла пояснити стаціонарність атомів.
Нільс Бор вважав, що стаціонарність є фундаментальною властивістю атомів, і сформулював такі два основних постулати, які є узагальненням експериментальних фактів з використанням уявлень Планка про випромінювання світлових квантів і Ейнштейна про поглинання квантів світла.
Перший постулат. Атомні системи можуть досить довго перебувати в певних стаціонарних станах, в яких вони не випромінюють і не вбирають енергію. В цих станах атоми мають дискретний ряд значень енергій  ,... Всяка зміна енергії відбувається стрибком при переході із одного стаціонарного стану
,... Всяка зміна енергії відбувається стрибком при переході із одного стаціонарного стану  до іншого
до іншого 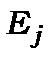 .
.
Другий постулат. При переході із одного стаціонарного стану з енергією Еn до іншого стаціонарного стану з енергією  атоми випромінюють або вбирають квант енергії електромагнітного випромінювання
атоми випромінюють або вбирають квант енергії електромагнітного випромінювання
 . (4.1)
. (4.1)
де  - cтала Планка (
- cтала Планка (  ). Ця формула називається правилом частот Бора.
). Ця формула називається правилом частот Бора.
Рівні енергії та стаціонарні орбіти
Стаціонарні стани руху електрона в кулонівському полі атомного ядра збігаються з рухом електронів по замкнутим орбітам. Вздовж цих орбіт виконується умова
|
|
|
 , (4.2)
, (4.2)
де квантове число,
квантове число,  - стала Планка,
- стала Планка,  - кутовий момент кількості руху. Умова квантування еквівалентна встановленню стоячої хвилі де Бройля на замкненій електронній орбіті. Дійсно, запишемо умову (4.2) для кругової орбіти в полі центральних сил, де
- кутовий момент кількості руху. Умова квантування еквівалентна встановленню стоячої хвилі де Бройля на замкненій електронній орбіті. Дійсно, запишемо умову (4.2) для кругової орбіти в полі центральних сил, де  .
.

або  , (4.3)
, (4.3)
де  -довжина хвилі де-Бройля.
-довжина хвилі де-Бройля.
Таким чином, на стаціонарній електронній орбіті укладається ціле число довжин хвиль де Бройля.
Знайдемо радіус стаціонарних орбіт за таких умов:
1. між електроном і позитивно зарядженим ядром діють електростатичні сили Кулона (доведено дослідами Резерфорда);
2. вважаємо, що електрон і ядро майже точкові заряди;
3. маса електрона значно менша за масу ядра, тому можна наближено вважати, що електрон рухається навколо нерухомого ядра, а ефективна маса системи електрон - ядро наближено дорівнює масі електрона
 ;
;
4. розглядається нерелятивістський випадок, коли нехтується залежністю маси частинок від їхньої швидкості;
5. використовується умова квантування (4.3);
|
|
|
6. враховуємо, щодоцентровою силою є електростатична сила Кулона
 (4.4)
(4.4)
Виключивши швидкість електронів v із (4.3) і (4.4), отримаємо
 , (4.5)
, (4.5)
де - квантове число. Найменший радіус електронної орбіти атома водню має місце при
- квантове число. Найменший радіус електронної орбіти атома водню має місце при  та
та 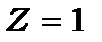 . Він називається радіусом першої борівської орбіти
. Він називається радіусом першої борівської орбіти і дорівнює:
і дорівнює:
 . (4.6)
. (4.6)
(в системі СІ ).
).
Радіус першої борівської орбіти  залежить лише від фундаментальних сталих і використовується, як одиниця довжини в атомній фізиці.
залежить лише від фундаментальних сталих і використовується, як одиниця довжини в атомній фізиці.
Знайдемо тепер енергії стаціонарних рівнів воднеподібних атомів з одним електроном і зарядом ядра 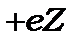
Повна енергія
 . (4.7)
. (4.7)
Для цього визначимо v2 із формули (4.4) і підставимо його в (4.7)
 . (4.8)
. (4.8)
Потенціальна енергія визначається з точністю до довільної сталої С. Якщо вважати, що при  потенціальна енергія дорівнює нулеві, то
потенціальна енергія дорівнює нулеві, то 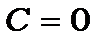 , й повна енергія електрона на стаціонарній орбіті буде від¢ємною
, й повна енергія електрона на стаціонарній орбіті буде від¢ємною
 (4.9)
(4.9)
Після підстановки у (4.9) виразу (4.5) для радіуса стаціонарної орбіти  , остаточно отримаємо:
, остаточно отримаємо:
 , (4.10)
, (4.10)
де 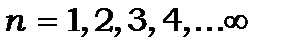 -головне квантове число, яке в теорії Бора визначає радіус стаціонарної орбіти та енергію електрона на стаціонарній орбіті,
-головне квантове число, яке в теорії Бора визначає радіус стаціонарної орбіти та енергію електрона на стаціонарній орбіті, 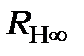 – стала розмірна величина, яка залежить від лише фундаментальних констант і має розмірність енергії. Вона називається сталою Рідберга і дорівнює:
– стала розмірна величина, яка залежить від лише фундаментальних констант і має розмірність енергії. Вона називається сталою Рідберга і дорівнює:
|
|
|
 . (виведена в наближенні
. (виведена в наближенні  ) (4.10а)
) (4.10а)
Найбільшу за абсолютною величиною енергію електрон має на стаціонарній орбіті з найменшим квантовим числом  . Ця енергія є енергією зв’язку електрона в атомі. Вона дорівнює енергії іонізації атома
. Ця енергія є енергією зв’язку електрона в атомі. Вона дорівнює енергії іонізації атома  , де потенціал
, де потенціал  називається потенціалом іонізації. Для атома водню, у якого
називається потенціалом іонізації. Для атома водню, у якого  , потенціал іонізації дорівнює
, потенціал іонізації дорівнює  В і збігається з його експериментальним значенням.
В і збігається з його експериментальним значенням.
Використавши правило частот Бора (4.1), запишемо формулу для хвильових чисел спектра водневих атомів
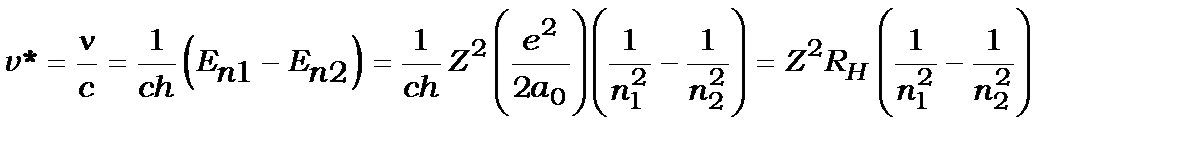 , (4.11)
, (4.11)
Запишемо сталу Рідберга як хвильове число, яке має розмірність см-1
 (4.12)
(4.12)
Індекс  в формулі (4.12) показує, що використана умова
в формулі (4.12) показує, що використана умова  коли можна знехтувати рухом атомного ядра
коли можна знехтувати рухом атомного ядра
 (4.13)
(4.13)
Формула (4.11) збігається з емпіричною узагальненою формулою Бальмера (3.21), яка добре описує експериментальні особливості атомних спектрів водню і воднеподібних атомів.
|
|
|
При збудженні електрона водневоподібних атомів до 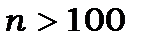 виникають сильнозбуджені атоми, які в літературі називають рідбергівськими атомами. Ці атоми інтенсивно вивчаться в науково-дослідних лабораторіях. Радіус їх орбіти при великих значеннях головного квантового числа може досягати часток міліметра, час життя цих атомів – секунди, а то й години [дивись 2, Задача №10, стр.141]. Частоти переходів між сусідніми рідбергівськими рівнями знаходяться в радіодіапазоні і збігаються з частотами обертання електрона на орбіті. Для таких атомів виконується закон Кеплера
виникають сильнозбуджені атоми, які в літературі називають рідбергівськими атомами. Ці атоми інтенсивно вивчаться в науково-дослідних лабораторіях. Радіус їх орбіти при великих значеннях головного квантового числа може досягати часток міліметра, час життя цих атомів – секунди, а то й години [дивись 2, Задача №10, стр.141]. Частоти переходів між сусідніми рідбергівськими рівнями знаходяться в радіодіапазоні і збігаються з частотами обертання електрона на орбіті. Для таких атомів виконується закон Кеплера  . Вони мають низький потенціал іонізації. На властивостях рідбергівських атомів засновані сучасні високочутливі прилади, наприклад, детектор інфрачервоного випромінювання, одноатомні мазери.
. Вони мають низький потенціал іонізації. На властивостях рідбергівських атомів засновані сучасні високочутливі прилади, наприклад, детектор інфрачервоного випромінювання, одноатомні мазери.
Модель атомів Бора пояснила такі властивості водневих атомів.
· (1) Закономірності спектральних серій, які описує узагальнена формула Бальмера (3.21), бо вона збігається з формулою (4.11) для хвильових чисел спектральних ліній атомного спектра водню в моделі Бора.
· (2) Квадратичну залежність хвильових чисел спектральних ліній від заряду ядра для ізоелектронного ряду водню (  ), тому що, згідно формули (4.11), при збільшенні
), тому що, згідно формули (4.11), при збільшенні  хвильові числа
хвильові числа  квадратично збільшується, або
квадратично збільшується, або , де
, де 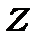 -заряд ядра водневоподібного іона. Ця властивість дозволила, зокрема, пояснити, чому деякі спектри, що випромінюють зірки, описуються формулою Бальмера з напівцілими квантовими числами. Дійсно, спектральна серія випромінювання від зірки
-заряд ядра водневоподібного іона. Ця властивість дозволила, зокрема, пояснити, чому деякі спектри, що випромінюють зірки, описуються формулою Бальмера з напівцілими квантовими числами. Дійсно, спектральна серія випромінювання від зірки  -Puppis, що спочатку приписувалась випромінюванню атомами водню серії Бальмера з напівцілими квантовими числами n, зводиться до серії Пікерінга спектра іонізованого атома гелію.
-Puppis, що спочатку приписувалась випромінюванню атомами водню серії Бальмера з напівцілими квантовими числами n, зводиться до серії Пікерінга спектра іонізованого атома гелію.
 , де
, де 
 , де
, де 
· (3) Врахування маси ядра M і перехід від маси електрона m0 до приведеної маси  дозволило отримати значення сталої Рідберга, п’ять знаків якої збігалися з експериментальним значенням сталої Рідберга, а саме:
дозволило отримати значення сталої Рідберга, п’ять знаків якої збігалися з експериментальним значенням сталої Рідберга, а саме:
 ,
,
а експериментальне  .
.
· (4) Використання приведеної маси дозволило також пояснити ізотопічний зсув спектральних ліній і використати його для визначення маси атомного ядра. Чим більша приведена маса, тим менша довжина хвилі, що випромінюється. Ця залежність дозволяє оцінювати маси ядер за допомогою спектроскопічних досліджень, наприклад дейтерію і тритію. Див.Демонстрацію [3].
· (5) Теорія Борапередбачила існування нових екзотичних атомних структур, таких, як позитроній, мезоатом, рідбергівський атом і їхні спектральні властивості.
Позитроній та мезоатом
Користуючись моделлю Бора, можна розглядати атомні структури, до складу яких будуть входити електрон і позитрон або протон і мезон. Ці атомні системи називаються позитронієм та мезоатомом відповідно. Вони є аналогами атома водню. Позитрон - це частинка з масою, що дорівнює масі електрона, і позитивним зарядом, який дорівнює заряду електрона (  і
і 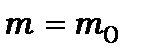 ). Мезон - це елементарна частинка, яка має заряд рівний заряду електрона і відрізняється від нього масою. Його маса в 207 разів більша за масу електрона (
). Мезон - це елементарна частинка, яка має заряд рівний заряду електрона і відрізняється від нього масою. Його маса в 207 разів більша за масу електрона (  і
і  ).
).
Згідно моделі Бора спектри цих незвичайних атомів повинні описуватись узагальненою формулою Бальмера, в якій потрібно врахувати заряд та приведену масу.
Для позитронію  ,
,  . Приведена маса для позитронію дорівнює
. Приведена маса для позитронію дорівнює  .
.
Підставимо цей вираз для приведеної маси в формулу (4.13) для сталої Рідберга, тоді
 (4.14)
(4.14)
Це означає, що всі спектральні лінії позитронію будуть зсунуті в бік більших довжин хвиль (в червону область спектра). Його енергія (потенціал) іонізації повинна бути вдвічі меншою за енергію (потенціал) іонізації атома водню

Позитроній дійсно був знайдений експериментально. Він утворюється при зіткненні повільних позитронів з атомами речовини. Позитрони захоплюють електрони атомів речовини і утворюють атоми позитронію з коротким часом життя. Після короткого часу життя позитрон зникає, тому що -е та +е анігілюють[9], утворюючи 2 або  -кванти. Час існування атомів позитронію досить малий ~10-10 секунди, проте вони були експериментально досліджені, і їх властивості виявились такими, як передбачає модель Бора. Екзотичною структурою, подібною до позитрона, є мюоній-система, що складається з електрона та
-кванти. Час існування атомів позитронію досить малий ~10-10 секунди, проте вони були експериментально досліджені, і їх властивості виявились такими, як передбачає модель Бора. Екзотичною структурою, подібною до позитрона, є мюоній-система, що складається з електрона та 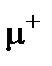 мезона, маса якого дорівнює
мезона, маса якого дорівнює  . Його параметри розраховуються аналогічно як для позитронію.
. Його параметри розраховуються аналогічно як для позитронію.
Для мезоатома[10] водню  , а ефективна маса значно більша за ефективну масу атома водню
, а ефективна маса значно більша за ефективну масу атома водню
 .
.
Це означає, що в формулі (4.13) для мезоатома стала Рідберга повинна бути замінена приблизно в ~200 разів більшою величиною по відношенню до атома водню,  . Спектральні лінії мезоатома водню повинні зсунутись по відношенню до спектральних ліній атома водню в короткохвильовий бік. Енергія (потенціал) іонізації мезоатома також суттєво зростає і дорівнює
. Спектральні лінії мезоатома водню повинні зсунутись по відношенню до спектральних ліній атома водню в короткохвильовий бік. Енергія (потенціал) іонізації мезоатома також суттєво зростає і дорівнює
 , що дійсно спостерігається експериментально.
, що дійсно спостерігається експериментально.
Доцільно також звернути увагу на те, що радіус першої стаціонарної орбіти мезоатома водню буде в ~186 разів меншим за радіус першої борівської орбіти водню
 .
.
А якщо утворити мезоатом з атомним номером  , тобто замінити в ньому один із електронів мезоном, то мезон повинен рухатись всередині атомного ядра, бо
, тобто замінити в ньому один із електронів мезоном, то мезон повинен рухатись всередині атомного ядра, бо 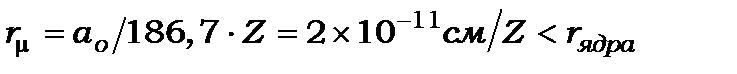 . Дослідження таких мезоатомів дає змогу отримувати відомості про будову атомного ядра. Крім того, наявність мезона в атомному ядрі збільшує час його взаємодії з ядром і тим самим може змінювати умови виникнення ядерних реакцій.
. Дослідження таких мезоатомів дає змогу отримувати відомості про будову атомного ядра. Крім того, наявність мезона в атомному ядрі збільшує час його взаємодії з ядром і тим самим може змінювати умови виникнення ядерних реакцій.
Дата добавления: 2018-05-09; просмотров: 806; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
