Визначення потенціалів іонізації атомів
Потенціалом іонізації називається такий потенціал  , при якому енергія електрона
, при якому енергія електрона 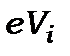 достатня для того, щоб він покинув нейтральний атом, і з атома утворився іон. Його можна визначати за допомогою приладів, аналогічних описаному в попередньому параграфі для кожного типу атома із набору характеристичних втрат. Проте здійснювати це не зовсім просто. Тому для вимірювання потенціалів іонізації використовують властивість повільних мало рухливих іонів компенсувати просторовий електронний заряд, який утворюється біля катода, що емітує електрони. Схема одного з таких приладівзображена на рис.3.9.
достатня для того, щоб він покинув нейтральний атом, і з атома утворився іон. Його можна визначати за допомогою приладів, аналогічних описаному в попередньому параграфі для кожного типу атома із набору характеристичних втрат. Проте здійснювати це не зовсім просто. Тому для вимірювання потенціалів іонізації використовують властивість повільних мало рухливих іонів компенсувати просторовий електронний заряд, який утворюється біля катода, що емітує електрони. Схема одного з таких приладівзображена на рис.3.9.
Джерелом електронів була електронна гармата (1), яка формувала електронний промінь з енергією електронів 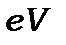 . Камера зіткнень (2) могла наповнюватись досліджуваним газом із тиском p. У камері зіткнень розташовувався масивний катод (3), котрий використовується для детектування появи іонів. Напруга на ньому
. Камера зіткнень (2) могла наповнюватись досліджуваним газом із тиском p. У камері зіткнень розташовувався масивний катод (3), котрий використовується для детектування появи іонів. Напруга на ньому 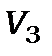 вибиралась значно меншою за напругу насичення термоелектронного струму, що може відбиратись від цього катода. При цій напрузі
вибиралась значно меншою за напругу насичення термоелектронного струму, що може відбиратись від цього катода. При цій напрузі 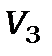 струм
струм  в колі масивного катода 3 був менший за струм насичення. Після напуску газу в камеру зіткнень і включення електронної гармати 1, коли вона утворює потік електронів у камері зіткнень із кінетичною енергією
в колі масивного катода 3 був менший за струм насичення. Після напуску газу в камеру зіткнень і включення електронної гармати 1, коли вона утворює потік електронів у камері зіткнень із кінетичною енергією  більшою за потенціал іонізації газу
більшою за потенціал іонізації газу  , то в камері зіткнень 2 з’являться іони.
, то в камері зіткнень 2 з’являться іони.
|
Рис.3.9. Схема для вимірювання потенціалів іонізації атомів.
|
Ці іони компенсують просторовий заряд масивного катода 3, і струм  в його колі різкозбільшиться. Таким чином, збільшення струму в колі масивного катода K3 є ознакою появи в камері зіткнень 2 іонів газу, що досліджуються. Це свідчить про те, що в камері зіткнень 2 з¢явились електрони з енергією більшою або рівною енергії іонізації атомів газу в камері (
в його колі різкозбільшиться. Таким чином, збільшення струму в колі масивного катода K3 є ознакою появи в камері зіткнень 2 іонів газу, що досліджуються. Це свідчить про те, що в камері зіткнень 2 з¢явились електрони з енергією більшою або рівною енергії іонізації атомів газу в камері (  ).
).
Цими вимірюваннями було встановлено, що кожний різновид атомівмає свій власний набір потенціалів іонізації. Наприклад,  ,
,  ;
;  і т.і. У багатоелектронного атома крім першого потенціалу іонізації може бути й другий, третій і т.д. потенціали іонізації, коли від нього відриваються два, три й т.д. електронів. Ці потенціали кратної іонізації значно більші за перший потенціал іонізації, коли з атома виривається один електрон. Потенціали іонізації можна визначати через частоти границь спектральних серій ( див. Демонстрацію 3).
і т.і. У багатоелектронного атома крім першого потенціалу іонізації може бути й другий, третій і т.д. потенціали іонізації, коли від нього відриваються два, три й т.д. електронів. Ці потенціали кратної іонізації значно більші за перший потенціал іонізації, коли з атома виривається один електрон. Потенціали іонізації можна визначати через частоти границь спектральних серій ( див. Демонстрацію 3).
Висновки
Викладені в попередніх розділах експериментальні факти дозволяють дійти до таких висновків:
1. До складу атомів входять позитивні й негативні заряди;
2. Найменший негативний заряд має електрон
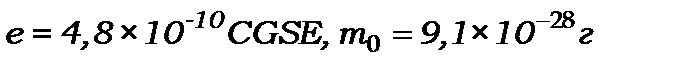 .
.
3. Його різмір співрозмірний з класичним радіусом електрона  , який значно менший газокінетичного розміру атома;
, який значно менший газокінетичного розміру атома;
|
|
|
4. Між електронами і ядром діють кулонівські сили  , при чому закон Кулона виявився справедливим на відстаннях до 10-13см.
, при чому закон Кулона виявився справедливим на відстаннях до 10-13см.
5. Заряд ядра (  ) майже точковий порівняно з розмірами атома, бо
) майже точковий порівняно з розмірами атома, бо  , де
, де  - відстань найменшого зближення частинок при пружному розсіянні в дослідах Резерфорда; Маса атома зосереджена у його ядрі;
- відстань найменшого зближення частинок при пружному розсіянні в дослідах Резерфорда; Маса атома зосереджена у його ядрі;
6. Енергетичний спектр електронів, що входять до складу атомів, дискретний;
7. Збуджені атоми випромінюють кванти світла з енергією  ;
;
8. Частоти спектральних ліній атома водню описуються узагальненою формулою Бальмера. Частоти спектральних ліній збігаються при наближенні до границь серій;
9. Спектральні лінії атомних спектрів підлягають комбінаційному принципу Рідберга - Рітца, згідно якого 
10. Кожний різновид атомів має свій власний потенціал іонізації.
Дата добавления: 2018-05-09; просмотров: 1066; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

