Комбінаційний принцип (Рідберга-Рітца)
У 1908 році фізики Рідберг і Рітц емпірично встановили, що різниця двох хвильових чисел однієї спектральної серії  і
і 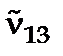 дає хвильове число іншої серії того ж самого атома
дає хвильове число іншої серії того ж самого атома
 . 3.18)
. 3.18)
Дійсно, якщо 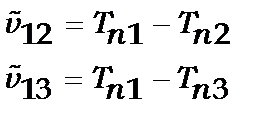 ,
,
то
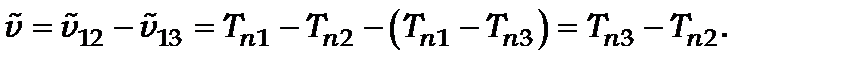 (3.19)
(3.19)
Неодноразова перевірка такої процедури з використанням різних значень хвильових чисел показала, що вона завжди дає узгоджений з експериментом результат, і дала підставу сформулювати комбінаційний принцип Рідберга-Рітца. Різниця хвильових чисел будь-якої спектральної серії атомних спектрів дорівнює хвильовому числу іншої серії цього ж самого атомного спектра, тобто спектральні лінії атомних спектрів можуть бути представлені комбінацією спектральних термів атома. Проте слід зауважити, що не всі спектральні лінії атомних спектрів, отримані таким чином, спостерігаються експериментально. Для повного збігання з дослідом необхідно додатково накласти емпіричніправила відбору на число ,які залежать від різновидуспектральних термів. Фізичний зміст та значення комбінаційного принципу Рідберга-Рітца згодом стануть зрозумілими при подальшому вивченні матеріалу.
,які залежать від різновидуспектральних термів. Фізичний зміст та значення комбінаційного принципу Рідберга-Рітца згодом стануть зрозумілими при подальшому вивченні матеріалу.
Спектр атомів водню
Спектр найпростішого одноелектронного атома водню вивчався багатьма дослідниками. Його спектральні серії отримали спеціальні назви. Установлено, що всі терми атома водню мають такий вигляд
 , (3.20)
, (3.20)
|
|
|
де  - стала Рідберга, а
- стала Рідберга, а  - квантове число, що набуває ряд цілих чисел 1, 2, 3,.... Комбінація цих термів дає можливість отримати будь-яку спектральну лінію атомарного водню за формулою
- квантове число, що набуває ряд цілих чисел 1, 2, 3,.... Комбінація цих термів дає можливість отримати будь-яку спектральну лінію атомарного водню за формулою
 . (3.21)
. (3.21)
Ця формула має назвуузагальненої формули Бальмера, де  ,
, ,
, ,...., а
,...., а - стала Рідберга (1854-1919 роки). Число
- стала Рідберга (1854-1919 роки). Число  визначає серію, а число
визначає серію, а число  - лінію цієї серії. Наприклад,
- лінію цієї серії. Наприклад, 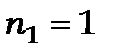 дає серію Лаймана, для якої узагальнена формула Бальмера має вигляд
дає серію Лаймана, для якої узагальнена формула Бальмера має вигляд

 ,. (3.22)
,. (3.22)
 ,
,
 ,
,
 ,
,  ,
,
|
Рис.3.6. Спектр атома водню (а). Серія Лаймана (б). Довжина відрізку відповідає інтенсивності спектральної лінії. |
тобто ця серія знаходиться в далекій ультрафіолетовій області спектра. За границею серії при  атом водню випромінює електромагнітні хвилі неперервного спектра. Спектр атома водню схематич зображений на рис.3.6.
атом водню випромінює електромагнітні хвилі неперервного спектра. Спектр атома водню схематич зображений на рис.3.6.
Серія Бальмера ,
,

 , де
, де  і
і
 (видима область спектра).
(видима область спектра).
Серія Пашена ,
, 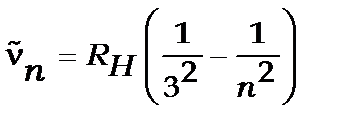 , де
, де 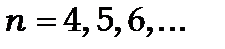 і
і
 (ближня інфрачервона область).
(ближня інфрачервона область).
Серія Брекета  ,
,  , де
, де  ...i
...i
 (інфрачервона область спектра).
(інфрачервона область спектра).
Легко перевірити, що узагальнена формула Бальмера збігається з виразом для комбінаційного принципу Рідберга - Рітца для спектральних ліній лінійчатого спектра атомарного водню. Експериментально спектр випромінювання атома водню можна спостерігати за методикою лабораторної роботи №3 [1]. Значення довжин хвиль всіх серій можна подивитись в таблицях спектральних ліній [6] та додатку демонстрації: «Спектр водню».
|
|
|
Формула Бальмера використовується для пояснення у першому наближенні спектрів атомів лужних металів та характеристичних рентгенівських спектрів всіх атомів.
Досліди Франка і Герца
Дата добавления: 2018-05-09; просмотров: 1029; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
