Декарбоксилирование аминокислот
Третий важный тип диссимиляции аминокислот – декарбоксилирование. В результате этой реакции удаляется a-карбоксильная группа и образуются физиологически активные соединения – биогенные амины. Биогенные амины оказывают сильное фармакологическое действие на множество физиологических функций человека и животных.
Реакции декарбоксилирования катализируют ферменты декарбоксилазы, простетической группой которых является пиридоксальфосфат (активная форма витамина В6).
Например, при декарбоксилировании гистидина образуется гистамин:

Он вызывает усиление деятельности желез внутренней секреции и снижает кровяное давление.
Декарбоксилирование является важной реакцией при разложении белков в результате жизнедеятельности гнилостных бактерий. Так, при декарбоксилировании лизина образуется кадаверин:
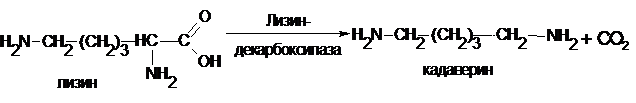
Из тирозина – тирамин, триптофана – триптамин, орнитина – путресцин.

Образующиеся при декарбоксилировании кадаверин, путресцин, триптамин являются основной причиной порчи мясных и рыбных продуктов.В то же время кадаверин и путресцин используются для синтеза полиаминов – спермидина и спермина. Играют важную роль в процессах клеточного деления, роста и дифференцировки ткани, а также в регуляции синтеза ДНК, РНК и белка.
При дальнейших превращениях, например, триптамина, образуются скатол и индол – ядовитые соединений, от которых в основном зависит запах гниющего мяса.
|
|
|
Декарбоксилирование аминокислот у растений приводит к биосинтезу алкалоидов – азотсодержащих органических соединений, обладающих более выраженной физиологической активностью, чем амины.
Продуктами декарбоксилирования аминокислот могут являться не только амины и диамины. Так, при декарбоксилировании дикарбоновых кислот, в частности глутаминовой кислоты образуется ¡-аминомасляная кислота:
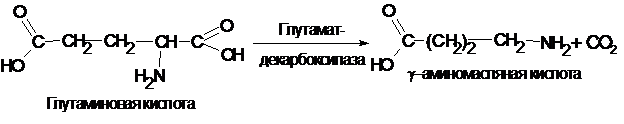 ¡-аминомасляная кислота накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор. Аналогично этому из аспарагиновой кислоты получается b-аланин, который принимает участие в синтезе пантотеновой кислоты (витамин В3).
¡-аминомасляная кислота накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор. Аналогично этому из аспарагиновой кислоты получается b-аланин, который принимает участие в синтезе пантотеновой кислоты (витамин В3).

Для микроорганизмов свойственно w-декарбоксилирование. Например, из аспарагиновой кислоты этим путем образуется a-аланин:

54.
Обезвреживание аммиака и биогенных аминов
Накопление биогенных аминов может отрицательно сказаться на физиологическом статусе и вызывать ряд существенных нарушений функций в организме.
Однако органы и ткани обладают специальным механизмом обезвреживания биогенных аминов. В данном случае биогенные амины подвергаются окислительному дезаминированию. Катализируют эти реакции ФАД – зависимые моноаминооксидазы и диаминоксидазы:
|
|
|
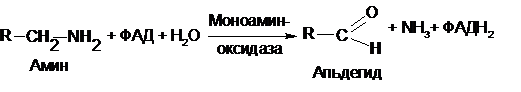
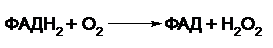

Как уже упоминалось выше, у растений амины могут использоваться для биосинтеза алкалоидов.
Аммиак, выделяющийся в реакциях дезаминирования и окисления биогенных аминов, является высокотоксичным соединением.
Один из путей связывания и обезвреживания аммиака в организме животных и растений – это биосинтез глутамина и аспарагина, а также восстановительное аминирование a-кетокислот (см. реакции биосинтеза аминокислот).
У человека, а также всех млекопитающих, амфибий и ряда других животных основным механизмом обезвреживания аммиака является биосинтез мочевины. Мочевина выводится с мочой в качестве главного конечного продукта белкового, азотного обмена.
Обезвреживание образующегося при дезаминировании аминокислот аммиака в виде мочевины свойственно не только животным, но также и различным представителям растительного мира. Исследования показали, что мочевина в растениях играет роль, аналогичную аспарагину и глутамину, т.е. является источником азота для построения белков в случае, если в растении появляется достаточное количество углеводов. Использование мочевины растениями и микроорганизмами для целей синтеза осуществляется благодаря наличию в них чрезвычайно активной уреазы, гидролизующей мочевину с образованием аммиака и угольной кислоты.
|
|
|
Механизм образования мочевины получил название орнитинового цикла мочевинообразования Кребса.
Дата добавления: 2018-05-02; просмотров: 1089; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
