Реакции биосинтеза аминокислот
В синтезе аминокислот источником азота служит аммиак, источником углерода являются промежуточные продукты цикла трикарбоновых кислот, гликолиза, гексозомонофосфатного цикла, цикла Кальвина.
Существуют следующие основные пути синтеза заменимых аминокислот.
1. Восстановительное аминированиеa-кетокислот:по этому пути неорганический азот (NH3) превращается в органический – входит в состав аминокислот.
2. Трансаминирование – перенос аминогруппы от аминокислоты – донора этих групп – к a-кетокислоте – акцептору групп.
3. Превращение одной аминокислоты в другую.
4. Прямое аминирование фумаровой кислоты.
Восстановительное аминирование a-кетокислот
В ассимиляции аммиака особая роль отводится промежуточному продукту ЦТК – a-кетоглутаровой кислоте. Под действием фермента глутаматдегидрогеназы, локализованной в матриксе митохондрий, из NH3 и a-кетоглутаровой кислоты синтезируется глутаминовая кислота (Глу), в качестве восстановителя используется НАДФН + Н+. Реакция протекает в две стадии через образование иминокислоты:

Суммарную реакцию восстановительного аминирования можно записать в следующем виде:
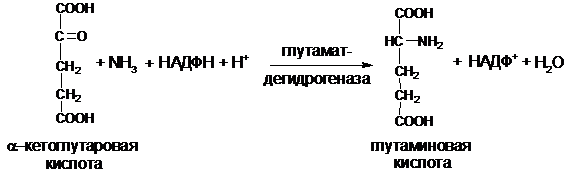
Эта реакция имеет фундаментальное значение в азотистом обмене растений, микроорганизмов, человека и животных.
Глутаминовая кислота является донором аминогрупп при биосинтезе всех белковых аминокислот. Она же – предшественник синтеза пролина и оксипролина и второго важного соединения, участвующего в ассимиляции NH3, – глутамина (Глн).
|
|
|
Глутамин служит затем источником азота в биосинтезе биомолекул, наиболее важными из которых являются пиримидины и пурины.

У многих бактерий аспарагиновая кислота служит предшественником амида аспарагиновой кислоты (Асн) в реакции, катализируемой аспарагинсинтетазой:

Глутаматдегидрогеназа и глутаминсинтетаза являются весьма активными ферментами и препятствуют накоплению токсичного аммиака в живой клетке в повышенных концентрациях, переводя его в связанную органическую форму – глутаминовую кислоту и глутамин.
Трансаминирование кислот
В реакции трансаминирования донором аминогрупп служит в основном глутаминовая кислота, их акцептором – a-кетокислоты – промежуточные продукты катаболизма моносахаридов; при этом образуются a-кетоглутаровая кислота и соответствующая аминокислота. Эта реакция катализируется пиридоксальзависимым ферментом – трансаминазой:

Если в качестве исходной a-кетокислоты используется пировиноградная кислота – конечный продукт гликолиза, то в результате реакции трансаминирования образуется аминокислота аланин (Ала):
|
|
|

Если оксалоацетат (ЩУК), то образуется аспарагиновая кислота (Асп).
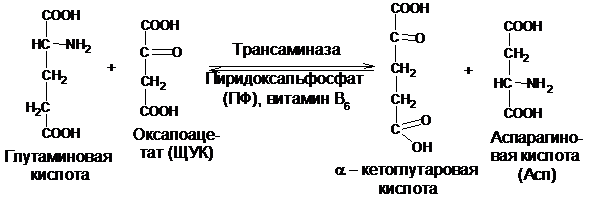
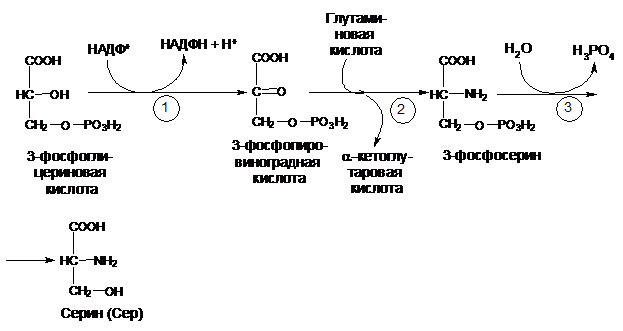
Глутаминовая кислота является донором аминогрупп при синтезе серина (Сер), углеродным скелетом которого является промежуточный продукт гликолиза – 3-фосфоглицериновая кислота. В первой стадии 3-фосфоглицериновая кислота окисляется до 3-фосфопировиноградной, которая подвергается трансаминированию с образованием 3-фосфосерина (реакция 2); последний под действием фосфатазы гидролизуется с образованием серина (Сер)(реакция 3):
Весьма сложен синтез аминокислоты гистидин (Гис). Исходным веществом в формировании имидазольной группы гистидина является АТФ, донором углеродного скелета боковой цепи гистидина служит фосфорибозилпирофосфат, а донором аминогрупп – глутамин. Реакция включает 11 стадий; лишь на последних стадиях синтеза осуществляется процесс трансаминирования.
Дата добавления: 2018-05-02; просмотров: 477; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
