Единицы измерения некоторых физических величин
| № | Физическая величина | Обозначение | Обозначение единицы измерения в системе СИ | Связь единиц измерения в системе СИ с единицами не входящими в эту систему |
| 1 | Объем | V | м3 | 1л = 10-3 м3 =1 дм3 |
| 2 | Масса | m | кг | 1г = 10-3кг; 1т = 103 кг |
| 3 | Плотность | r | кг/м3 | 1 г/см3 =1кг/дм3=1т/м3=103кг/м3 |
| 4 | Сила | F | Н | 1Н = 1 кг·м/с2; 1дин =10-5Н |
| 5 | Давление | р | Па | 1Па=1Н/м2=1кг/(с2·м); 1бар=105Па; 1мм.рт.ст.=133 Па 1атм.=1.01325·105 Па |
| 6 | Работа | А | Дж | 1Дж =1Н·м = 1кг·м2/с2 |
| 7 | Энергия | W, E | Дж | 1Эв = 1.60219·10-19 Дж |
| 8 | Количество теплоты | Q | Дж | 1кал = 4.1868 Дж; 1эрг = 10-7Дж |
| 9 | Теплоемкость | С | Дж/К | 1Дж/К=1Н·м/К =1кг·м2/(с2 ·К) |
| 10 | Удельная теплоемкость | с | Дж/(кг·К) | 1Дж/(кг·К)=1 м2/(с2 ·К) |
| 11 | Молярная теплоемкость | Сm | Дж/моль×К | 1 Дж/моль×К= 1 кг∙м2 /с2 ×моль×К |
| 12 | Молярная масса | М | кг/моль | 1кг/моль =103 г/моль |
| 13 | Молярный объем | Vm | м3/моль | 1 м3 /моль=106 см3 /моль |
| 14 | Количество вещества | n | моль | 1моль-10-3кмоль |
| 15 | Концентрация | n | м-3 | 1м-3 =106см-3 |
| 16 | Энтропия | S | Дж/К | 1ккал/(кг·К)=4186.8 Дж/(кг·К) |
| 17 | Температура | Т | К | 1 К =273 + t0 С |
Таблица А.2.
Универсальные физические постоянные
| № | Величина | Обозначение | Числовое значение и ед.измерения в СИ |
| 1 | Число Авогадро | NA | 6,02·1023 моль-1 |
| 3 | Постоянная Больцмана | k | 1,38·10-23Дж/К |
| 4 | Постоянная газовая универсальная | R | 8,31 Дж/(моль·К) |
Таблица А.3.
Плотности
Газы при нормальных условиях
| Вещество | r,103 (кг/м3) | Вещество | r,103 (кг/м3) |
| Углекислый газ | 1,977 | Воздух | 1,293 |
| Кислород | 1,429 | Водород | 0,08988 |
Таблица А.4.
Эффективные диаметры молекул и атомов
| Вещество | d, 10-10м | Вещество | d, 10-10м |
| Углекислота (СО2) | 4,0 | Водяной пар (Н2О) | 3,0 |
| Азот (N2) | 3,7 | Водород (Н2) | 2,7 |
| Кислород (О2) | 3,5 | Гелий (Не) | 2,0 |
Таблица А.5.
Постоянные Ван –дер –Ваальса
| Вещество | 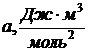
| 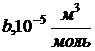
| Вещество | 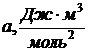
| 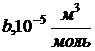
|
| Азот | 0,136 | 4 | Кислород | 0,137 | 3 |
| Аргон | 0,132 | 3 | Углекислый газ | 0,364 | 4,3 |
| Вода | 0,554 | 3 |
Таблица А.6.
Критические значения температуры и давления
| Вещество | Ткр, К | Ркр, МПа | Вещество | Ткр, К | Ркр, МПа |
| Азот | 126 | 3.4 | Водяной пар | 647 | 22.0 |
| Аргон | 151 | 4,87 | Гелий | 5,2 | 0,23 |
| Бензол | 562 | 4,8 | Кислород | 154 | 5,07 |
| Водород | 33 | 1,3 | Углекислый газ | 304 | 7,4 |
Таблица А.7.
Коэффициенты внутреннего трения (вязкости)
Жидкостей, газови паров
| Вещество | t, 0C | 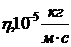
| Вещество | t, 0C |  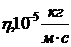
|
| Азот | 0 | 1,67 | Вода | 20 | 100,4 |
| Воздух | 21,6 | 1,72 | Гелий | 0 | 1,86 |
| Кислород | 0 | 1,92 | Пары воды | 0 | 0,87 |
| Углекислый газ | 0 | 1,37 | Хлор | 0 | 1,29 |
Ключевые слова
Абсолютная температура
Адиабата
Атом
Броуновское движение
Вязкость
Газ идеальный
- реальный
Градиент плотности
- скорости
- температура
Давление
- парциальное
Диффузия
Изопроцессы
- изобарный
- изотермический
- изохорный
Изотермы
Молекула
Молекулярная физика
Начало термодинамики первое
- второе
- третье
Объём удельный
Параметры состояния
Скорость молекул – средняя
-арифметическая
-квадратичная
-наивероятная
Средняя длина свободного пробега
Температура
Теплоёмкость
-молярная
-удельная
Теплопроводность
Формула барометрическая
Функция распределения Больцмана
Оглавление
Введение. 3
Таблица вариантов. 4
I.1 Основы молекулярно-кинетической теории идеальных газов. 7
I. 2 Примеры решения задач. 9
I.3. Задачи к теме «Основы молекулярно-кинетической теории». 11
II. 1 Статистическая физика. Распределение Максвелла. Барометрическая формула. 21
II.2 Примеры решения задач. 23
II.3 Задачи к теме «Статическая физика. Распределение Максвелла. Барометрическая формула». 25
III.1 Физическая кинетика. Явления переноса. 28
III.2 Примеры решения задач. 29
III.3 Задачи к теме « Физическая кинетика. Явления переноса». 32
IV.1 Физические основы термодинамики. Первое начало термодинамики 34
IV.2 Примеры решения задач. 37
IV.3 Задачи к теме « Первое начало термодинамики». 40
V.1 Второе начало термодинамики. Циклы. Кпд циклов. 55
V.2 Примеры решения задач. 2
V.3 Задачи к теме «Второе начело термодинамики. Циклы. Кпд циклов» 2
VI.1 Реальные газы.. 2
VI.2 Примеры решения зада. 2
VI.3. Задачи к теме «Реальные газы». 2
Библиографический список. 2
Приложение А. 2
Ключевые слова. 2
Татьяна Сергеевна Розанова
Надежда Николаевна Демина
ФИЗИКА
ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Учебное пособие для студентов инженерно – технических специальностей вузов.
Отв. редактор В.Ф.Сакаш
Редактор РИЦ
Техн. редактор
__________________________________________________________________
Подписано в печать.
Формат 60×84 1/16. Усл. печ.л. 10,875.
Изд.№ Заказ № Тираж 250 экз.
Лицензия ИД №06543. 16.01.02.
________________________________________________________________
Редакционно-издательский центр СибГТУ
660049, Красноярск, пр.Мира, 82
Дата добавления: 2018-04-15; просмотров: 250; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
