Первое начало термодинамики ( Закон сохранения и превращения энергии в термодинамике)
– интегральная форма первого начала, где 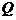 – количество теплоты, полученное системой,
– количество теплоты, полученное системой, 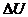 – приращение внутренней энергии системы,
– приращение внутренней энергии системы, 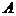 – работа совершаемая системой.
– работа совершаемая системой.
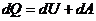
– дифференциальная форма первого начала, где dU - бесконечно малое изменение внутренней энергии системы, dA - элементарная работа, dQ - бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а dA и dQ таковыми не являются.
Общая формула для расчета количества теплоты
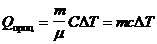 .
.
Применение первого начала термодинамики к идеальным газам
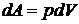 – элементарная работа.
– элементарная работа.
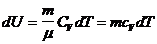 ,
,
где 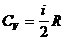 – молярная теплоемкость при постоянном объеме;
– молярная теплоемкость при постоянном объеме;
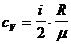 – удельная теплоемкость при постоянном объеме.
– удельная теплоемкость при постоянном объеме.
Таблица 1
| Изопроцесс | 1-е началотермодинамики | Теплоемкость | Количество теплоты | Совершаемая работа |
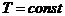 (изотермич.)
(изотермич.)
|
|
|
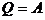
|
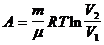
|
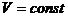 (изохорич.)
(изохорич.)
|
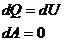
| 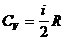 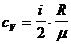
| 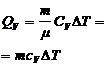
|
|
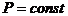 (изобарич.)
(изобарич.)
|
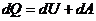
| 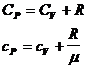
| 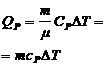
|
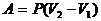
|
| Адиабатический |
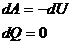
|
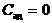
|
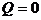
| 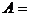
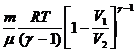
|
8 Адиабатический процесс.Процесс, при котором отсутствует теплообмен между системой и окружающей средой. (таблица 1) 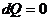 ;
;
1) 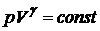 , 2)
, 2) 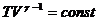 , 3)
, 3) 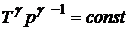 ;
;
для двух состояний:
1) 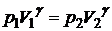 , 2)
, 2) 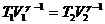 , 3)
, 3) 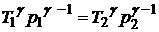 ,
,
где 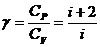 – показатель адиабаты (коэффициент Пуассона);
– показатель адиабаты (коэффициент Пуассона);
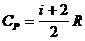 – молярная теплоемкость при постоянном давлении;
– молярная теплоемкость при постоянном давлении;
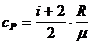 – удельная теплоемкость при постоянном давлении,
– удельная теплоемкость при постоянном давлении,
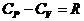 .
.
IV.2 Примеры решения задач
|
|
|
ЗАДАЧА IV.1 Водород, масса которого 6,5 г , находящийся при температуре 27° С, расширяется вдвое при р = const за счет притока тепла извне. Найти: 1) работу расширения; 2) изменение внутренней энергии; 3) количество теплоты, сообщенное газу.
Дано: 6,5 г=6,5∙10-3 кг; р = const; 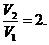
Найти: А-? DU-? Q-?
Решение
Приступая к решению задачи, прежде всего надо выявить характер процесса, протекающего в газе, и использовать соответствующие формулы табл.1.
1. Вычислим значения молярных теплоемкостей водорода, учитывая, что молекулы водорода двухатомные и число степеней свободы i = 5:
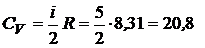 Дж/(моль К),
Дж/(моль К),
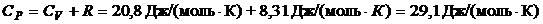 .
.
2. Используя условие задачи и уравнение для изобарического процесса 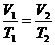 , найдем температуру газа после расширения:
, найдем температуру газа после расширения:
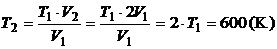 .
.
3. Вычислим изменение внутренней энергии и количество теплоты:
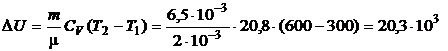 (Дж),
(Дж),
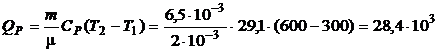 (Дж).
(Дж).
4. На основании первого начала термодинамики найдем работу расширения газа
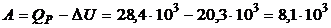 (Дж).
(Дж).
ЗАДАЧА IV.2 Двухатомный идеальный газ, занимающий при давлении
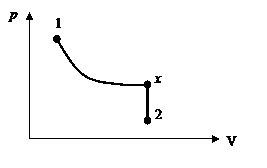
р1 = 3×105 Па объем V1= 4 л, расширяется до объема V2= 6 л, при этом давление падает до значения р2 = 105 Па. Процесс происходит сначала по адиабате, затем по изохоре (рисунок 12). Определить работу сил давления газа, изменение его внутренней энергии и количество поглощенной теплоты при этом переходе.
|
|
|
Дано: р1 = 3×105 Па ; р2 = 105 Па; V1= 4 л = 4 ×10 м-3; V2= 6 л=6 ×10 м-3 .
 Найти: А-? DU-? Q-?
Найти: А-? DU-? Q-?
Решение
1. Газ участвует в двух процессах: а) адиабатное расширение из состояния 1 в некоторое состояние x, в котором объем
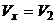 (1)
(1)
Рисунок 12
давление рx не известно; б) изохорный процесс из состояния x в состояние 2. Найдем рx из уравнения адиабаты для двух состояний
|
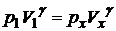 . (2)
. (2)
Для двухатомного газа i = 5, следовательно
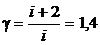 . (3)
. (3)
Значение рх получим на основании (1), (2) и (3), а именно
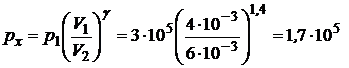 (Па).
(Па).
Откуда видим, что 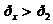 , и процесс 1-2 можно представить графически (рис.1).
, и процесс 1-2 можно представить графически (рис.1).
Учтем, что 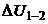 не зависит от вида процесса, а зависит только от начального и конечного состояний. Следовательно,
не зависит от вида процесса, а зависит только от начального и конечного состояний. Следовательно,
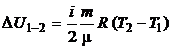 .
.
Из уравнения Клапейрона - Менделеева для состояний 1 и 2 имеем
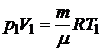 и
и 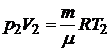
откуда получим
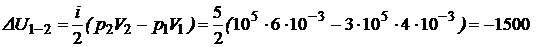 (Дж)
(Дж)
а это значит, что газ охлаждается.
2. Работу А1-2найдем как сумму работ: 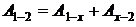 , где для изохоры х–2 Ах–2 = 0, для адиабаты 1–х:
, где для изохоры х–2 Ах–2 = 0, для адиабаты 1–х:
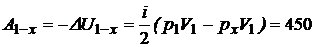 (Дж),
(Дж),
т.е. 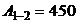 (Дж).
(Дж).
3. Количество теплоты Q1-2 складывается также как сумма теплот: 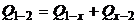 , где (табл.1) для адиабаты Q 1–x = 0, для изохоры х–2:
, где (табл.1) для адиабаты Q 1–x = 0, для изохоры х–2:
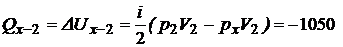 (Дж),
(Дж),
т.е. 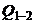 = – 1050 Дж, а это значит, что газ отдает тепло.
= – 1050 Дж, а это значит, что газ отдает тепло.
|
|
|
ЗАДАЧА IV.3При изобарическом расширении некоторой массы двухатомного газа, находящегося под давлением 105Па, его внутренняя энергия изменилась на 490 Дж. Найти приращение объема газа.
Дано: р=105 Па; DU=490 Дж; g = 1,4.
Найти: DV - ?
Решение
Чтобы определить приращение объема DV при изобарическом расширении, нужно знать работу, произведенную газом при этом процессе: 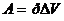 .
.
Работу можно вычислить и на основании первого начала термодинамики: 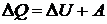 , откуда следует, что
, откуда следует, что 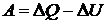 .
.
Количество тепла DQ, сообщенное при изобарическом расширении произвольной массе газа, равно: 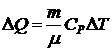 .
.
Изменение внутренней энергии DU, которое произойдет при этом 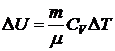 .
.
Разделив 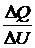 , получим:
, получим: 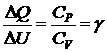 ,
, 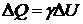 .
.
Подставим это значение в уравнение для работы:
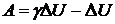 , или
, или 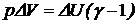 .
.
Отсюда найдем, что 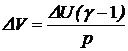 . DV = 1,96·10-3 м3.
. DV = 1,96·10-3 м3.
Дата добавления: 2018-04-15; просмотров: 313; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
