Растворы сильных электролитов. Обменные реакции
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
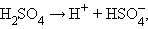
При этом электролит полностью диссоциирует (α > 30%), но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
Обменные реакции между электролитами протекают до конца в следующих случаях: а) если образуется малорастворимое соединение; б) выделяется газ; в) образуется слабый электролит.
Задача 1.Составьте молекулярные и ионно-молекулярные уравнения взаимодействия в растворах между:
1) CuSO4 + H2S →
2) BaCO3 + HNO3 →
3) FeC13 + KOH →
Решение:
1) CuSO4 + H2S → CuS↓ + H2 SO4
Cu2+ + SO42- + H2S = CuS↓ + 2 H+ + SO42-
Cu2+ + H2S = CuS↓ + 2 H+
2) BaCO3 + HNO3 → Ba (NO3)2 + CO2 + H2O
BaCO3 + 2 H++ 2 NO3- = Ba2+ + 2 NO3- + CO2 + H2O
BaCO3 + 2 H+ = Ba2+ + CO2 ↑+ H2O
3) FeC13 + 3 KOH → Fe(OH)3 + 3 KC13
Fe3+ + 3C1- + 3 K+ + 3 OH-= Fe(OH)3 ↓ + 3 K+ + 3C1-
Fe3+ + 3OH-= Fe(OH)3 ↓
Задача 2. Составьте молекулярные и ионно-молекулярные уравнения реакций:
а) Cr(OH)3 + KOH
б) NaNO2 + H2SO4
в) Ba(OH)2 + H2SO4
Решение:
а) Cr(OH)3 + 3 KOH = К3 [Cr(OH)6]
Cr(OH)3 + 3 К+ + 3 ОН- = 3 К+ + Cr(OH)63-
Cr(OH)3 + 3 ОН- = Cr(OH)63-
б) 2 NaNO2 + H2SO4 = 2НNO2 + Na2SO4
2 Na+ + 2 NO2- + 2 H+ + SO4 2- = 2НNO2 + 2Na+ + SO4 2-
2 NO2- + 2 H+ - = 2НNO2
NO2- + H+ -= НNO2
в) Ba(OH)2 + H2SO4 = BaSO4 + Н2О
Ba2+ + 2 ОН- + 2 H+ + SO4 2- = BaSO4 + Н2О
Задача 3.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Be(OH)2 + NaOH; б) Cu(OH)2 + НNO3; в) ZnOHNO3 + НNO3;
Решение:
а) Be(OH)2 + 2 NaOH = Na2[Be(OH)4]
|
|
|
Be(OH)2 + 2 Na+ + 2 OH- = 2 Na+ + [Be(OH)4]2-
Be(OH)2 + 2 OH- = [Be(OH)4]2-
б) Cu(OH)2 + 2 НNO3 = Cu(NO3)2 + 2 H2O
Cu (OH)2 + 2 Н+ + 2 NO3- = Cu2+ + 2 NO3-+ 2 H2O
Cu (OH)2 + 2 Н+ = Cu2+ + 2 H2O
в) ZnOHNO3 + НNO3 = Zn(NO3)2 + H2O
ZnOH+ + NO3-+ Н+ + NO3- = Zn2+ + 2 NO3- + H2O
ZnOH+ + Н+ =Zn2+ + H2O
Задача 4. Составьте молекулярные и ионно-молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Zn2+ + H2S = ZnS + 2 H+
б) HCO-3 + H+ = H2O + CO2↑
в) Ag+ + Cl- = AgCl
Решение:
а) Zn2+ + H2S = ZnS + 2 H+
ZnCl2 + H2S = ZnS + 2 HCl
Zn2+ + 2 Cl- + H2S = ZnS + 2 H+ + 2 Cl-
б) HCO-3 + H+ = H2O + CO2
KHCO3 + HCl = H2O + CO2 + KCl
K+ + HCO-3 + H+ + Cl- = H2O + CO2 + K+ + Cl-
в) Ag+ + Cl- = AgCl
AgNO3 + KCl = AgCl + KNO3
Ag+ + NO-3 + K+ + Cl- = AgCl + K+ + Cl-
Гидролиз солей
В водных растворах соли полностью диссоциируют на катионы и анионы. Кроме них в растворе есть ионы H+ и OH–, образующиеся вследствие диссоциации молекул воды. Если эти ионы при взаимодействии с ионами соли образуют плохо диссоциирующие соединения, то идет гидролиз соли – разложение соли водой с образованием слабого электролита.
Возможность и характер протекания гидролиза определяется природой соли:
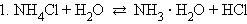
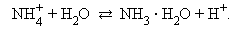
Гидролиз идет по катиону и pH < 7.
Константа равновесия:
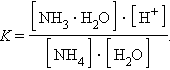
Так как [H2O] = const, то K∙ [H2O] = Kг – константа гидролиза. Тогда:
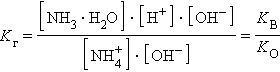
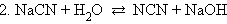
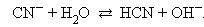
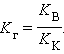
Гидролиз идет по аниону, pH > 7
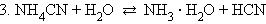
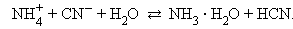
Гидролиз идет по аниону и катиону, и величина pH в этом случае зависит от относительной силы образующихся кислоты и основания.
|
|
|
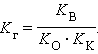
Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются.
Для многозарядных катионов и анионов гидролиз протекает ступенчато, причем в основном по 1-й ступени.
Например, для хлорида железа (FeCl3 → Fe3+ + 3Cl–) имеем:
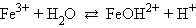
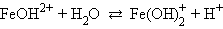
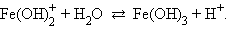
Распространенной ошибкой при составлении уравнений гидролиза является использование сразу более одной молекулы воды.
Правильно: 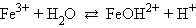
Неправильно: 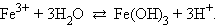
Гидролиз хлорида железа идет преимущественно по первой ступени из-за накапливания ионов H+ и недостатка гидроксильных ионов, необходимых для протекания реакции гидролизаничтожно мала:
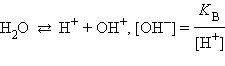
В результате гидролиза многозарядных катионов образуются основные соли Fe(OH)Cl2, Fe(OH)2Cl, а гидролиз многозарядных анионов приводит к образованию кислых солей (NaHCO3, NaH2PO4).
Задача 1.Составьте ионно-молекулярное и молекулярное уравнение гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию.
Решение:
а) Соли, образованные сильным основанием и слабой кислотой в водных растворах подвергаются гидролизу с накоплением ионов OH- (имеют щелочную реакцию среды)
KNO2 + H2O ↔ KOH + HNO2
|
|
|
K+ + NO-2 + H2O ↔ K+ +OH- + HNO2
NO-2 + H2O↔ HNO2 + OH- - щелочная реакция среды, рН > 7
б) Соли, образованные слабым основанием и сильной кислотой в водных растворах подвергаются гидролизу с накоплением ионов Н+ (имеют кислую реакцию среды)
Fe 2 (SO4)3 + 2 Н2О ↔ 2 (Fe ОН) SO4 + H2SO4
2 Fe3+ + 3 SO42- + 2 Н2О ↔ 2 Fe ОН2+ + 3 SO42- + Н+
Fe3+ + Н2О ↔ Fe ОН2+ + Н+ - кислая реакция среды, рН < 7
Задача 2. Какие из солей Fe2 (SO4)3, (NH4)2S, NaCl, K3AsO4 подвергаются гидролизу? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей.
Решение:Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К ним относятся NaCl, K3AsO4.
Для остальных солей составим уравнения гидролиза:
А) Fe 2 (SO4)3 + 2 Н2О ↔ 2 (Fe ОН) SO4 + H2SO4
2 Fe3+ + 3 SO42- + 2 Н2О ↔ 2 Fe ОН2+ + 3 SO42- + Н+
Fe3+ + Н2О ↔ Fe ОН2+ + Н+ - кислая реакция среды, рН < 7
Б) (NH4)2S – соль, образованная слабым основанием и слабой летучей кислотой, поэтому она полностью подвергается гидролизу.
(NH4)2S + Н2О ↔ NH4ОН + Н2S
2 NH4+ + S2- ↔ NH4ОН ↑ + Н2S↑
Задача 3.Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaC1O; MgC12 или ZnC12? Почему?
Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
Решение:1) NaCN или NaC1O?
|
|
|
Степень гидролиза той или иной соли определяется константой диссоциации слабого электролита.
Чем меньше константа диссоциации слабого электролита, входящего в состав соли, тем больше степень гидролиза.
Поэтому, сравним Кдисс. слабых кислот.
КНCN = 7,9*10-10
КНC1O = 5,0*10-8
Следовательно, NaCN подвергается гидролизу в большей степени.
NaCN + H2O ↔ NaOH + НCN
Na+ +CN- + H2O ↔ Na+ + OH- + НCN
CN- +H2O ↔ OH- + НCN
pH> 7 (щелочная реакция среды)
NaC1O + H2O ↔NaOH + НC1O
Na+ +C1O- + H2O ↔ Na+ + OH- + НC1O
C1O- +H2O ↔ OH- + НC1O
2) MgC12илиZnC12?
В этом случае надо сравнивать произведения растворимости ПР.
ПР (Mg (OH) 2) = 1,8*10-11
ПР (Zn (OH) 2) = 7,0*10-18
Большему гидролизу подвергается Zn C12
Уравнения гидролиза:
MgC12 +H2O ↔ MgOHC1 + HC1
Mg2+ + 2 C1- + H2O ↔ MgOH+ + 2 C1- + H+
Mg2+ +H2O ↔ MgOH+ + H+
pH< 7 (кислая реакция среды)
ZnC12 + H2O ↔ZnOHC1 + HC1
Zn2+ +H2O ↔ ZnOH+ + H+
pH< 7 (кислая реакция среды)
Дата добавления: 2018-04-15; просмотров: 269; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
