Скорость химической реакции. Химическое равновесие
Скорость и механизм химических процессов составляют основу химической кинетики.
Скорость гомогенной химической реакции определяется по изменению концентрации любого из реагирующих веществ в единицу времени. Обычно концентрации выражают в моль/л, а время в секундах. Например, скорость реакции:

может быть, с одной стороны, определена по убыли веществ A или В, а с другой стороны, по приращению продуктов реакции L и Q. Поскольку все вещества этой реакции взаимодействуют в стехиометрических соотношениях, то скорость реакции может быть выражена через изменение концентрации любого реагента. Другими словами, при фиксированной температуре скорость гомогенной реакции Vi определяется убылью или приращением концентрации реагента Ci за бесконечно малое время dτ:
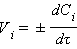
Так, скорость реакции: N2(г) + 3H2(г) = 2NH3(г) может быть выражена соотношением:
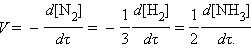
Скорость реакции в момент τ – мгновенная скорость; Vτ – подчиняется закону действующих массдля реакции: A + B,
VAB = k [A] [B]
Коэффициент пропорциональности называют константой скорости. Очевидно, для реакции aA + bB, то есть для a молей вещества А и b молей вещества В ЗДМ формально запишется в виде:
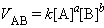
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Это определение относится к гомогенным реакциям. Если реакция гетерогенная (реагенты находятся в разных агрегатных состояниях), то в уравнениезакона действующих масс входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
|
|
|
Константа скорости k численно равна скорости, если концентрации реагентов постоянны и равны единице.
Задача 1.В системе CO + Cl2 →COCl2 концентрацию СО увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Решение:
Скорость прямой реакции можно определить по уравнению:
V = k [CO][Cl2]
V = k * 0, 03*0,02 = k* 6*10-4
VI = k *0,12* 0,06 = k* 72*10-4
VI/V=(k* 72*10-4) / (k* 6*10-4) = 12 раз
Ответ: скорость прямой реакции возросла в 12 раз.
При фиксированной температуре реакция возможна, если взаимодействующие молекулы обладают определенным запасом энергии.
Аррениус эту избыточную энергию назвал энергией активации, а сами молекулы активированными.
Константа скорости k и энергия активации Ea связаны соотношением, получившим название уравнения Аррениуса:
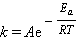
A – предэкспоненциальный множитель, R – универсальная газовая постоянная, T – абсолютная температура.
Чем больше Ea, тем меньше число активных молекул и тем медленнее протекает реакция. При уменьшении Ea скорость возрастает, а при Ea = 0 реакция протекает мгновенно.
|
|
|
Величина Ea характеризует природу реагирующих веществ и определяется экспериментально из зависимости k = f(T).
В логарифмическом виде для констант при двух температурах Ea:

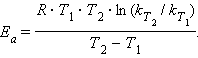
Задача 2.Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличиться в 2 раза?
Решение:Энергию активации можно определить по уравнению Аррениуса:
Еакт = 2,303 Rlg(Vt2 /Vt1) *{T2 *T1 / (T2 -T1)} =
= 2,303* 8,3144 lg2 {300*290/(300-290)} = 49976 Дж ≈50 кДж
lg2 = 0,3
Ответ: энергия активации 50 кДж.
Задача 3.Для реакции 2 NOBr → 2 NO + Br2 известны константы скорости 0,321 и 1,117 л*моль-1*с-1 при 273 и 287 К, соответственно. Вычислите коэффициенты уравнения Аррениуса.
Решение:1.Зависимость константы скорости от температуры выражается уравнением Аррениуса:
k = Ae-E/RT, где А – предэкспоненциальный коэффициент.
k1 = A1 *e -E/RT1; k2 = A2 *e -E/RT2
lg k1 = - A1 *E/RT1 ; lg k2 = - A2 *E/RT2
2. Энергия активации определяется по уравнению Аррениуса:
E = 2,303 R lg(k2/k1)*[T1T2/(T2-T1)] =
= 2,303 * 8,3144 *lg(1,117/0,321)*273*287/(287-273) = 54169 Дж
lg 3,48 =0,5416
3.lg k1 * RT1 = - A1 *E →
A1 = - (lg k1 * RT1) /E; lg k1 = lg 0,321= - 2 +1,5065= - 0,4935
A2 = - (lg k2 * RT2) /E; lg k2 = lg 1,117 = 0,0479.
A1 = + (0,4935*8,3144*273)/54169 = + 0,02
A2 = - (0,0479*8,3144*287)/54169 = - 0,002
|
|
|
Ответ: A1 = + 0,02; A2 = - 0,002
Если Ea = 50–100 кДж∙моль–1, то из уравнения Аррениуса следует, что при изменении температуры реакции на 10 градусов ее скорость изменится в 2–4 раза(Вант-Гофф):


γ – температурный коэффициент скорости химической реакции.
Задача 4.Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 1200 до 800С?Температурный коэффициент скорости реакции равен 3.
Решение:
Δt = 1200 - 800 = 400
γ = 3.
По уравнению Вант-Гоффа:
V2/V1 = γ Δt/ 10 = 340/10 = 34 = 81 раз
Ответ: Скорость реакции уменьшится в 81 раз.
Задача 5.На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (γ = 2,5)?
Решение:По уравнению Вант-Гоффа:
V2/V1 = γ Δt/ 10
Прологарифмируем: 2,5Δt/ 10 = 30
lg 30 = (Δt/ 10) * lg 2,5
1,4771 = (Δt/ 10) * 0,3979
(Δt/ 10) = 1,4771*10/ 0,3979 = 37,120
Ответ: необходимо повысить температуру на 370.
Для обратимых реакций: aА + bВ ↔ lL + mМзакон действующих масс в состоянии равновесия характеризуется константой равновесия.
Константа равновесия, выраженная через равновесные концентрации Kc или через парциальные давления Kр, принимает вид:

При постоянной температуре отношение равновесных концентраций (парциальных давлений) конечных продуктов к равновесным концентрациям (парциальным давлениям) исходных реагентов, возведенных соответственно в степени, равные их стехиометрическим коэффициентам, величина постоянная.
|
|
|
Равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
1. Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов.
Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой.
Реакция CO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
2. Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
3. Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира)
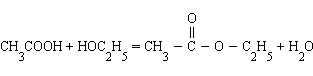
увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов.
Задача 6. Константа равновесия реакции N2 (г) + 3 H2 (г) ↔ 2 NH3 (г) равна 0,1. Равновесные концентрации водорода и аммиака равны 0,6 и 0,18 моль/л соответственно. Вычислите равновесную и исходные концентрации азота.
Решение:
1. Константа равновесия определяется по уравнению:
Кр = [NH3]2/[ N2]*[ H2]3 = 0,1
Отсюда, равновесная концентрация азота:
[N2] = 0,182 / 0,63 *0,1 = 1,5 моль/л
2. Из 1 моль азота образуется 2 моль аммиака, следовательно, на 0,18 моль/л аммиака было затрачено ½ концентрации азота,т.е. 0,09 моль/л азота.
Исходная концентрация азота составит:
0,09 + 1,5 = 1,59 моль/л
Задача 7.Напишите выражение для константы химического равновесия гетерогенной системы С + Н2О(г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
Решение:Константа равновесия данной системы:
Кр = [CO]*[H2]/[ Н2О] – в этом случае не учитывается концентрация твердой фазы.
2. С + Н2О(г) ↔ СО + Н2
1 моль 1 моль+1моль
а) При увеличении давления равновесие будет смещаться в сторону меньшего объема, т.е. в сторону образования паров воды.
б) Увеличение концентрации СО и Н2 приведет к смещению равновесия в сторону их расхода, т.е. в сторону обратной реакции – образования паров воды.
Дата добавления: 2018-04-15; просмотров: 397; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
