Молекула. Моль. Стехиометрические законы. Основные газовые законы. Закон Авогадро. Мольный объем газа
Федеральное агентство связи
Федеральное государственное образовательное бюджетное учреждение высшего профессионального образования
«Поволжский государственный университет телекоммуникаций и информатики»
КОЛЛЕДЖ СВЯЗИ
Утверждаю
Зам. директора по УПР
___________Н.В.Черненкова
«____» _____________2014г.
Методика решения задач
По дисциплине «Химия»
(для практических занятий и самостоятельной работы студентов)
по программе, утверждённой зам. директора по УВР Логвиновым А.В.
«_____» _________2013 года
для специальностей:
080114 «Экономика и бухгалтерский учёт в связи»
210709 «Многоканальные телекоммуникационные системы»
210723 «Сети связи и системы коммутации»
230115 «Программирование в компьютерных системах»
230401 «Информационные системы в связи»
Рассчитано на 39 часов
РАССМОТРЕНО
на заседании цикловой комиссии № 1«Общих гуманитарных дисциплин»
Председатель комиссии М.М. Никифоров
Протокол № ____ от «____» _________2014 г.
Самара
2014 г.
Шукова, М.Г. Методика решениязадач по дисциплине «Химия» (для практических занятий и самостоятельной работы студентов): Учебное пособие– Самара:КС ПГУТИ, 2014.– 111 с.
Содержание
1 Атом.. 4
2 Молекула. Моль. Стехиометрические законы. Основные газовые законы. Закон Авогадро. Мольный объем газа. 6
3 Выводы химических формул. 10
4 Эквивалент. Закон эквивалентов. 13
|
|
|
5 Электронная структура атомов. 22
6 Периодическая система элементов. Основные классы неорганических соединений. 29
7 Химическая связь. 37
8 Энергетика химических реакций. 44
9 Скорость химической реакции. Химическое равновесие. 51
10 Способы выражения растворенного вещества в растворе. 56
11 Растворы слабых электролитов. 63
12 Растворы сильных электролитов. Обменные реакции. 65
13 Гидролиз солей. 67
14 Растворимость. Произведение растворимости. 70
15 Окислительно-восстановительные реакции. 72
16 Химические источники тока. 74
17 Электролиз. 76
18 Коррозия. 77
19 Свойства элементов и их соединений. 79
20 Органическая химия. 84
20.1 Изомерия и номенклатура органических соединений. 84
20.2 Предельные углеводороды.. 86
20.3 Углеводороды с двойной связью.. 89
20.4 Алкины.. 91
20.5 Арены.. 94
20.6 Спирты. Фенолы.. 96
20.7 Альдегиды.. 99
20.8 Карбоновые кислоты.. 101
20.9 Сложные эфиры. Жиры. Моющие средства. 103
20.10 Углеводы.. 105
20.11 Азотосодержащие органические соединения. 107
20.12 Полимеры.. 110
Атом
Химия изучает свойства веществ и закономерности процессов, сопровождающихся изменениями их структуры и состава.
Объектами изучения в химии служат: атомы, ионы, молекулы, радикалы, растворы, коллоидные и дисперсные частицы, кристаллические, стеклообразные и полимерные системы, координационные и кластерные соединения.
|
|
|
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.
Атомный номер Z равен числу протонов в атомном ядре. В электронной оболочке электронейтрального атома содержится Zэлектронов.
Массовое число A равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N.
Нуклиды – атомы с определенным числом протонов и нейтронов.
Изотопы – атомы с одинаковым Z, но разными N.
Изобары – атомы с одинаковым A, но разными Z.
Изотоны – атомы с одинаковым N, но разными A.
Элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) и число протонов Z (нижний).
Атомная масса – масса атома в атомных единицах массы (а. е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
Относительная атомная масса (безразмерная величина): 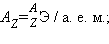
Она численно равна атомной массе элемента.
Элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) и число протонов Z (нижний).
|
|
|
Задача 1. Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение.
Число электронов равно Z = 73, следовательно, число протонов так же равно Z = 73.
Массовое число атома А = Z + N = 181, тогда число нейтронов равно:
N = А – Z = 181 – 73 = 108
Это – тантал 181 73Ta
Задача2.Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробными числами? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
Решение:Ядра, содержащие одинаковое число протонов, входят в состав атомов одного и того же элемента. Но они могут содержать различное число нейтронов и, следовательно, иметь разную массу. Разновидности атомов одного и того же химического элемента, отличающиеся своей массой, называются изотопами(«равное место»).
Почти все химические элементы состоят из нескольких изотопов, поэтому их атомные массы, являющиеся средними арифметическими величинами от масс изотопов, выражаются не целыми, а дробными числами. Для водорода известно три изотопа: протий 11Н (легкий или обычный водород), дейтерий 21Н или D (тяжелый водород) и тритий 31Н или Т (сверхтяжелый водород).
|
|
|
Кислород состоит из трех изотопов: 168О; 178О;188О.
Среди многочисленных изотопов различных элементов можно найти ядра разного заряда, но с одинаковой массой. Различные элементы, атомы которых обладают одинаковой массой, называют изобарами («равная тяжесть»).
Очевидно, что изобары содержат одинаковое число нуклонов, но разные числа протонов и, следовательно, нейтронов. Например, изобары: 4018Ar;4019K;4020Ca.
Задача 3. Символ одного из изотопов элемента5224Э. Указать: а) название элемента; б) число протонов и нейтронов в ядре) число электронов в электронной оболочке атома.
Решение. Число протонов Z = 24, число нейтронов N = А – Z = 52-24 = 28.
Это - хром 5224Cr
Число электронов равно порядковому номеру или числу протонов.
24Cr–( 2ê ( 8 ê ( 8 ê ( 6 ê
n = 1 n = 2 n = 3 n = 4
24Cr – 1s2 2s22р6 3s23р6 4s23d4
Задача 4.Природный магний состоит из изотопов 24Mg; 25Mg; 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6; 10,1 и 11,3.
Решение:
Средняя атомная масса природного магния:
А = 24*0,786 + 25*0,101 + 26* 0,113 = 24,327 а.е.м.
Задача 4. Природный хлор представлен двумя изотопами 35Сl и 37Сl. Во сколько раз ядер 35Сl больше, чем ядер 37Сl?
Для решения использованием правило креста (правило Пирса).
Найдем разницу в числах по диагонали 35-35,5 =-0,5; 37-35,5 =1,5
35Сl 35 1,5
35,5
37Cl 37 0,5
Ответ: Полученное соотношение 1,5:0,5 свидетельствует, что атомов хлора с массовым числом 35 в три раза больше.
Молекула. Моль. Стехиометрические законы. Основные газовые законы. Закон Авогадро. Мольный объем газа
Молекула – наименьшая частица вещества, определяющая его свойства, способная к самостоятельному существованию. Состоит из одинаковых или разных атомов.
Соединения, образованные одинаковыми атомами, называют простыми (He, O2, O3, H2, S8), а образованные разными атомами – сложными (H2O, H2O2, NH3, CCl4, C2H5OH).
Моль - количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода с атомной массой, равной 12.
Молярная масса (M) – масса одного моля вещества, численно совпадающая с относительными массами атомов, ионов, молекул, радикалов и других частиц, выраженных в г∙моль–1.
Или: масса 1 моля вещества (мольная масса), выраженная в граммах, численно равна относительной молекулярной массе этого вещества.
Число Авогадро – число частиц в моле любого вещества:
NA = 6,02∙1023 моль–1.
Задача 1.Вычислите в молях: а) 6,02*1022 молекул С2Н2; б) 1,80 *1024 атомов азота; в) 3,01 *1023 молекул NH3. Какова молярная масса указанных веществ?
Решение:
Моль – это количество вещества, в котором содержится число частиц (молекул, атомов, ионов), равное числу Авогадро (NA = 6,02 *1023).
Отсюда:
а) 6,02*1022: 6,02 *1023 = 0,1 моль молекул С2Н2;
б) 1,80 *1024 : 6,02 *1023 = 29,9 моль атомов азота;
б) 3,01 *1023 : 6,02 *1023 = 0,5 моль молекул NH3.
Задача 2.Одинаково ли число молекул в 0,001 кг Н2 и 0,001 кг О2?
Решение.Молярная масса водорода равна 2 г/моль, молярная масса кислорода – 32 г/моль.
Число моль ν = m/ M
Следовательно, в 1 г (0,001 кг) содержится:
а) 1г :2 г/моль = 0,5 моль Н2;
б) 1г :32г/моль = 0,03125 моль О2.
Число АвогадроNA = 6,02∙1023 моль–1.
Отсюда, число молекул:
а) 6,02∙1023 моль–1*0,5 моль = 3,01∙1023молекул Н2;
б) 6,02∙1023 моль–1*0,03125 моль = 0,188∙1023 молекул О2.
Следовательно, в 1 г водорода число молекул больше, чем в 1 г кислорода в 16 раз:
3,01∙1023/ 0,188∙1023 = 16,0.
Задача 3.Выразить в граммах массу одной молекулы СО2.
Решение. Молекулярная масса углекислого газа равна 44.Следовательно, мольная масса СО2 равна 44 г/моль.В 1 моле углекислого газа содержится 6,02 ·1023 молекул.
Отсюда находим массу одной молекулы:
m= 44/ (6,02 ·1023) = 7,31 · 10-23 г.
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод формул химических соединений, составляют раздел химии, называемый стехиометрией. Стехиометрия включает в себя законы Авогадро, постоянства состава, кратных отношений, Гей-Люссака, эквивалентов и сохранения массы.
Состояние газа характеризуется его температурой, давлением и объемом. Если температура равна 273 К, а давление равно нормальному атмосферному (760 мм ртутного столба или 101, 325 кПа), то условия, при которых находится газ, называются нормальными.
Закон простых объемных отношений (Ж. Гей-Люссак): При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов как небольшие целые числа.
Закон Гей-Люссака: при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре Т:
V1 / T1= V2 /T2или V/ T = const.
Закон Бойля-Мариотта:
При постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа:
P  V
V  = const или P2 / P1 = V1 / V2 .
= const или P2 / P1 = V1 / V2 .
Зависимость между объемом газа, давлением и температурой можно выразить общим уравнением, объединяющим законы Бойля- Мариотта и Гей-Люссака:
PV/ T = P0V0/ T0.
В уравнении буквенные обозначения с индексом «0» относятся к нормальным условиям существования газа, а без индексов -к любым условиям.
Закон Авогадро: В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул.
Из закона Авогадро вытекают два следствия:
1) Одинаковое число молекул любых газов при одинаковых условиях занимают одинаковый объем.
2) Относительная плотность одного газа по другому равна отношению их молярных масс.
Молярный объем – объем моля любого газа при нормальных условиях; равен 22,4 л∙моль–1.
Задача 4.Какой объем при нормальных условиях занимают 27*1021 молекул газа?
Решение. Число Авогадро – число частиц в моле любого вещества:
NA = 6,02∙1023 моль–1.
Следовательно, 27∙1021 молекул газа соответствуют:
27∙1021/6,02∙1023 = 4,485*10-2 моль газа.
Объем моля любого газа при нормальных условиях равен 22,4 л/моль.
Отсюда: 4,485*10-2 моль*22,4 л/моль ≈ 1 л
Ответ: 27*1021 молекул газа при нормальных условиях занимают объем, равный 1 л.
Задача5. При некоторой температуре давление газа, занимающего объем 3 л, равно 93,3 кПа (700 мм рт. ст.). Каким станет давление газа, если, не изменяя температуры, уменьшить объем газа до 2,8 л?
Решение. Обозначив искомое давление через P2, можно найти его величину:P2/ 93,3 = 3/ 2,8.
Тогда P 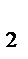 = 93, 3 * 3/ 2,8 = 100 кПа (750 мм рт. ст.).
= 93, 3 * 3/ 2,8 = 100 кПа (750 мм рт. ст.).
Задача6. При 270С объем газа 600 мл. Какой объем займет газ при570С, если давление будет оставаться постоянным?
Решение. По условию задачи V1 = 600 мл, Т1=273+ 27 = 300 К.
Подставляя эти значения в уравнение Гей-Люссака, получим:
600/300 = V2/ 330, откуда V2 = 600 * 330/ 300 = 660 мл.
Задача 7.Какой объем при 210С и давлении 142 кПа будут занимать0,07 кг азота?
Решение. 1. По закону Авогадро Объем моля любого газа при нормальных условиях занимает объем 22,4 л/моль.
M(N2) = 28 г/моль
28 гN2 при н.у. занимают объем 22,4 л
70 гN2 при н.у. занимают объем х л
х = 70 г* 22,4 л/ 28 г = 56 л
2. Приводим полученный объем к указанным в задаче условиям:
Т = 273 + 21 = 294 К
По закону Бойля- Мариотта и Гей-Люссака:
PV/ T = P0V0/ T0.
V = P0V0T/ PT0 = (101,3 кПа * 56 л* 294К)/ 142кПА*273К ≈ 43 л
Ответ: при 210С и давлении 142 кПа 0,07 кг азотабудут занимать объем в 43 л.
Задача 8.В каком объемном соотношении необходимо смешать водород и углекислый газ, чтобы получить газовую смесь по плотности равную воздуху.
Решение:
Вариант 1.Квадрат Пирса (правило креста). По закону Авогадро, равные количества газов занимают равные объемы. Следовательно, если молярные массы газов равны, значит, равны и их плотности. Поэтому, нужно смешать водород и углекислый газ так, чтобы средняя молярная масса полученной газовой смеси была равна молярной массе воздуха (29 г/моль). Определив молярные массы H2 и СO2, зная среднюю молярную массу воздуха, расставим их в виде треугольника:
H22
воздух 29
СO244
Найдем разницу в числах по диагонали 2-29=-27; 44-29=15. Отбросив минус, проставим их, в соответствии с диагональю, по которой они были определены 27 - напротив CO2; 15 - напротив H2:
H2 2 15
воздух 29
CO2 44 27
Соотношение 15:27 и будет ответом.
Вариант 2.Введем два неизвестных. Примем количество одного компонента за x, а второго - за y.
Воспользуемся формулой n=m/M и, преобразовав, получим:
Mсм= mсм/nсм.
Помня, что mcм=m(H2) + m(CO2), а nсм=n(H2) + n(CO2) получим:
29=(2х + 44y)/(x + y).
Упростив, получим, что 27х=15y.
Полученное соотношение говорит о том что, водород с углекислым газом необходимо смешать в молярном (объемном) соотношении 27:15, что подтверждает ответ, полученный при решении по первому варианту.
Ответ: Углекислый газ и водород необходимо смешать в объемном соотношении 15:27.
Выводы химических формул
В химических процессах соблюдается закон сохранения массы.
В основу составления химических уравнений положен метод материального баланса, основанный на законе сохранения массы (М. В. Ломоносов, 1748, А. Лавуазье, 1789).
В современном виде закон формулируется следующим образом:
Общая масса продуктов реакции равна общей массе веществ, вступивших в реакцию:
Σm продуктов = Σm реагентов
Количественные расчеты в химии либо основаны на знании количе-ственного состава реагирующих веществ, либо служат его определению.
Закон постоянства состава (Ж. Пруст): Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом.
Закон кратных отношений (Д. Дальтон): Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Вещество характеризуется качественным, количественным и атомным составом.
Качественный, или элементарный, состав показывает, какие элементы образуют данное вещество. Для перекиси водорода Н2О2– это водород и кислород (Н и О), для криолита Na3AlF6- натрий, алюминий и фтор (Na, Al и F).
Количественный (весовой) состав - это отношения масс (m) всех элементов, образующих данное вещество.
При взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамм кислорода, что соответствует отношением 2:1, 1:1, 2:3, 1:2, 2:5 в этих оксидах; их составы N2O, NO, N2O3, NO2, N2O5.
Для перекиси водорода количественный состав описываетсяотношением:
mн:m0= 1 : 16
или, если массу вещества принять за 100%, mн= 5,9% и m0= 94,1%.
Зная формулу вещества; и атомные массы (А) образующих его элементов, можно рассчитать количественный состав этого вещества.
Эмпирическая формула составляется из атомных символов элементов, записываемых в определенном порядке друг за другом.
Формулы веществ показывают, какие элементы и в каком количестве входят в состав вещества. Различают формулы простейшие и молекулярные.
Молекулярная формула показывает действительное число атомов каждого элемента в молекуле(для веществ молекулярного строения).
Для вывода простейшей формулы вещества достаточно знать его состав и атомные массы образующих данное вещество элементов.
Молекулярная формула соответствует истинному молекулярному составу соединения: S2Cl2, C6H6, а не SCl, CH. При изменении состава молекулы в зависимости от температуры берут самую простую формулу: S, P, NO2 вместо S8, P4, N2O4.
Простейшаяформула выражает наиболее простой возможный атомный состав молекул вещества, соответствующий отношениям масс между элементами, образующими данное вещество.
В структурной формуле указываются последовательность соединения атомов в молекуле (плоская структурная формула) и пространственное расположение атомов в соединении (проекционная структурная формула).
Задача 1. Найти простейшую формулу оксида хрома, содержащего 68,4 % (массовых) хрома.
Решение. Обозначим числа атомов хрома и кислорода в простейшей формуле оксида соответственно через х и у. Атомные массы хрома и кислорода равны 52 и 16. Поэтому массы хрома и кислорода в составе оксида относятся как: 52х : 16у.
По условиям задачи это отношение равно 68,4: 31,6.
Следовательно,52х : 16 у = 68,4: 31,6
откуда х: у = 68,4/ 52: 1,98 / 16 = 1,32 : 1,98.
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на меньший из них:
х: у = 1 : 1,5 = 2 : 3
Таким образом, простейшая формула оксида хрома Cr2 O3.
Для нахождения молекулярной формулы вещества необходимо кроме состава вещества знать его молекулярную массу.
Задача 2. Газообразное соединение азота с водородом содержит 12,5 % (масс.) водорода. Плотность соединения по водороду равна 16. Найти молекулярную формулу соединения.
Решение. Находим отношение числа атомов азота х к числу атомов водорода ув молекуле соединения:
х :у = 87,5 / 14 : 12,5 / 1 = 6,25 : 12,5 = 1 : 2
Простейшая формула соединения NH2.
Этой формуле отвечает молекулярная масса, равная 16. Истинную молекулярную массу вещества находим, исходя из его плотности по водороду:М = 2 * 16 = 32.
Таким образом, истинная молекулярная масса вещества вдвое больше вычисленной по его простейшей формуле.
Следовательно, молекулярная формула соединения N2 H4.
Задача 3.Найти простейшую формулу вещества, содержащего по массе 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Решение.Атомные массы натрия, углерода и кислорода равны 23, 12 и 16. Обозначим числа атомов соответственно через x, y и z.
x:y:z = 43,4/23 : 11,3/12 : 45,3/16 = 1,887 : 0,942 : 2,831
Полученное соотношение делим на самое маленькое число
x:y:z = 2 : 1 : 3
Ответ: простейшая формула соединения: Na2CO3
Задача 4.Найти молекулярную формулу вещества, содержащего по массе 93,75 % углерода и 6,25 % водорода, если плотность этого вещества по воздуху равна 4,41.
Решение.1.Мольная масса воздуха равна 29 г/моль, тогда, молекулярная формула вещества равна:
М = 29*DВ = 4,41 * 29 г/моль = 127,89 г/моль
2. Атомные массы углерода и водорода равны 12 и 1.
x:y = 93,75/12 : 6,25/1 = 7,8125 : 6,25 = 1,25 : 1 = 5 : 4
Простейшая формула углеводорода С5Н4.
М (С5Н4) = 64 г/моль; 127,89/64 = 2
Ответ: молекулярная формула углеводорода: С10Н8.
4 Эквивалент. Закон эквивалентов
Закон эквивалентов (И. Рихтер): В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты.
Химический эквивалент – реальная или условная частица вещества, способная соединиться и заместить 1 моль атомов водорода в реакциях присоединения и замещения или принять (отдать) 1 моль электронов в окислительно-восстановительных реакциях.
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалентной массой называется масса 1 эквивалента вещества.
Для определения эквивалента (эквивалентной массы) необязательно исходить из его соединения с водородом. Их можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен.Согласно закону эквивалентов эквивалентные массы сложныхвеществ определяют по следующим формулам:
М оксида
Э оксида = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾;
Число атомов элемента * валентность элемента
М кислоты
Э кислоты = ¾¾¾¾¾¾¾¾¾¾¾¾¾;
Основность кислоты
М основания
Э основания = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾;
Кислотность основания
М соли
Э соли = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾.
Число атомов металла * на валентность металла
Эквивалентным объемом называется объем, занимаемый при данных условиях 1эквивалентом вещества.
Эквивалентный объем водорода равен11,2 л/моль
Задача 1. Определить эквивалент и эквивалентные массы элементов в соединениях HBr, H2O, NH3.
Решение. В указанных соединениях с 1 молем атомов водорода соединяется 1 моль атомов брома, 1/2 моля атомов кислорода и 1/3 атомов азота.
Согласно определению, эквиваленты брома, кислорода и азота равны соответственно 1 молю, 1/ 2 моля и 1/ 3 моля.
Исходя из мольных масс атомов этих элементов, находим эквивалентные массы этих элементов: у Br она равна 79,9 г/ моль, у кислорода - 16 * 1/2 = 8 г/ моль, у азота- 14 *1/3 = 4,67 г / моль.
Задача 2. Один оксид марганца содержит 22,56% кислорода, а другой – 50,50%. Вычислите эквиваленты марганца в этих оксидах.
Решение. 1. Содержание марганца в первом оксиде:
100 – 22,56 = 77,44%
Эквивалент кислорода равен 8,0. Тогда по закону эквивалентов:
На 77,44 вес.ч. Mn приходится 22,56 вес. ч. кислорода
Э (Mn) - « - « - « - «- « - «- « - « - Э (О)
Э (Mn) = 77,44* 8 / 22,56 = 27,46 г/моль
Валентность марганца:
В (Mn) = М (Mn)/ Э (Mn) = 54,93/ 27,46 = 2
Следовательно, формула оксида марганца: MnО
2. Содержание марганца во втором оксиде:
100 – 50,50 = 49,50 %
На 49,50 вес.ч. Mn приходится 50,50 вес. ч. кислорода
Э (Mn) - « - « - « - «- « - «- « - « - Э (О)
Э (Mn) = 49,50* 8 / 50,50 = 7,84 г/моль
Валентность марганца:
В (Mn) = М (Mn)/ Э (Mn) = 54,93/ 7,84 = 7
Ответ: формула оксида марганца: Mn2О7.
Задача 3. При сгорании 5 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла
Решение.В оксиде металла на кислород приходится:
9,44 – 5,00 = 4,44 г кислорода
По закону эквивалентов:
Массы реагирующих веществ относятся между собой как эквиваленты этих веществ.
Эквивалент кислорода равен 8.Отсюда:
На 5 г металла приходится 4,44 г кислорода
Э металла – « - « - « - Э кислорода (8)
Э металла = 8*5/4,44 = 9,01 г/моль
Ответ: эквивалент металла равен 9,01 г/моль.
Задача 4.Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из галогенов. Определить эквивалентную массу галогена.
Решение:По закону эквивалентов:
Массы реагирующих веществ относятся между собой как эквиваленты этих веществ.
Эквивалент кислорода равен 8.Отсюда:
0,2 г кислорода соответствует 3,17 г одного из галогенов
Э кислорода – « - « - « - Э галогена
Э галогена = 8*3,17/ 0,2 = 126,8
Ответ: эквивалент галогена равен 126,8 г/моль
Задача 5. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, эквивалент которого равен 1/2 моля?
Решение:1. Эквивалентная масса магния равна:
Э = М * f = 24 г/моль * ½ = 12 г/моль
По закону эквивалентов:
Массы реагирующих веществ относятся между собой как эквиваленты этих веществ.
Эквивалент кислорода равен 8.Отсюда:
Э кислорода – « - « - « - Э магния
хг кислорода – « - « - « - 21 г магния
Масса кислорода = 8*21 /12 = 14 г кислорода
2. Сколько литров кислорода расходуется при этом?
Масса 1 л кислорода равна 1,4 г
ул кислорода весят 14 г
ул = 14*1 / 1,4 = 10 л.
Ответ: при сгорании 21 г магния расходуется 10 л кислорода.
Задача 6. Определить эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида.
Решение:
1. По закону эквивалентов:
Массы реагирующих веществ относятся между собой как эквиваленты этих веществ.
Эквивалент кислорода равен 8.
Масса кислорода в 3,48 г оксида равна:
3,48 – 3,24 = 0,24 г
отсюда:Э кислорода – « - « - « - Э металла
0,24 г кислорода – « - « - « - 3,24 г металла
Э металла = 8* 3,24 / 0,24 = 108 г/моль
2. Масса серы в сульфиде равна:3,72 – 3,24 = 0,48 г
Э серы – « - « - « - Э металла (108 г/моль)
0,48 г серы– « - « - « - 3,24 г металла
отсюда:Э серы = 0,48 * 108 / 3,24 = 16 г /моль
Ответ: Эквивалент металла равен 108 г/моль, эквивалент серы – 16 г/моль.
Задача7.При восстановлении 1,485 г оксида металла, выделилось 0,41 л оксида углерода СО. Вычислить эквивалентную массу металла.
Решение:
1,485 г0,41 л
1. MeO + C= CO + Me
ЭMeO ЭСО
По закону эквивалентов:
1,485 г оксида - « - « - 0,41 лСО
Э MeO - « - « - 11,2 лСО
Отсюда:
Э MeO = 1,485 * 11,2 / 0,41 = 40,56 г/моль
2. Эквивалентная масса кислорода равна 8 г/моль
Тогда, эквивалентная масса металла равна:
40,56 – 8 = 32,56 г/моль
Ответ: эквивалентная масса металла равна 32, 56 г/моль.
Задача 8. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найти эквивалентную массу железа и его эквивалент, если известно, что эквивалентная масса серы равна 16 г/ моль.
Решение. Из условия задачи следует, что в сульфиде железа на 5,6 г железа приходится 8,8 - 5,6 = 3,2 г серы.
Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Тогда:
5,6 г железа эквивалентны 3,2 г серы,
Э 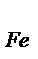 г/ моль 16 г серы.
г/ моль 16 г серы.
Из соотношения следует, что эквивалентная масса железа равна:
5,6 *16/ 3,2= 28 г/ моль.
Мольная масса атомов железа, численно совпадающая с его относительной молекулярной массой, равна 56 г/моль.
Эквивалент железа равен: 28 г/моль: 56 г/ моль = 1/ 2.
Задача9.0,432 г металла образовали 0,574 г хлорида. Вычислить эквивалент металла, приняв эквивалент хлора равным 35,5.
Решение:
- Определим массу хлора в хлориде:
m (Cl) = 0,574 – 0,432 = 0,142 г
2. По закону эквивалентов:
Массы реагирующих веществ относятся между собой как эквиваленты этих веществ.
m (Me) - m (Cl)
Э (Me) - Э (Cl)
Э (Me) = m (Me)* Э (Cl) / m (Cl)
Э (Me) = 0,432 г * 35,5 / 0,142 г = 108 г / моль-экв
Ответ: эквивалент металла равен 108 г / моль-экв.
Задача 10.При восстановлении водородом 10,17 г оксида двух-валентного металла образовалось 2,25 г воды, эквивалент которой 9,0. вычислите эквивалент оксида и эквивалент металла. Чему равен атомный вес металла.
Решение. Составим уравнение реакции:
10,17 г2,25 г
МеО + Н2 → Ме + Н2О
Э(МеО) Э(Н2О) = 9 г/моль
По закону эквивалентов:
10,17 г МеО - 2,25 гН2О
Э(МеО) 9 г/моль Н2О
Э(МеО) = 10,17*9/2,25 = 40,68 г/моль
Так как оксид образует двухвалентный металл:
М (МеО) = 40,68 г/моль * 2 = 81,36 г/моль
М (Ме) =М (МеО) – М(О) = 81,36 – 16,0 = 65,36 г/моль
Это – цинк. Валентность металла равна 2.
Э (Zn) = М (Zn)/ В(Zn) = 65,36 /2 = 32,68 г/моль.
Задача 11. Некоторое количество металла, эквивалентная масса которого равна 28 г/ моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Решение.Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентом газообразного вещества.
Так, 1 моль водорода Н2 занимает объем 22,4 л при нормальных условиях, эквивалент водорода равен 1 мольатомов то в 22,4 л Н2 содержится 2 эквивалента, значит, эквивалентный объем водорода равен 22,4/2=11,2 л/моль.
Составляем пропорцию:
28 г металла эквивалентны 11,2 л водорода
хг металла эквивалентны 0,7 л водорода.
Тогда х = 0,7 * 28 / 11,2 = 1,75 г.
Ответ: масса металла1,75 г.
Задача 12.Вычислить эквиваленты H2SO4 и Al(ОН)3 в реакциях, выражаемых уравнениями:
H2SO4 +КОН = KHSO4 + H2O (1)
H2SO4+ Mg = MgSO4 + H2 (2)
Al(ОН)3 + HCl=Al(OH)2Cl + Н2О (3)
Al(OH)3 + 3HNO3 = A1(NO3)3 + 3H2O (4)
Решение. Эквивалент сложного вещества, как и эквивалент элемента, может иметь различные значения и зависит от того, в какую реакцию вступает это вещество.
Так, эквивалент H2SO4 в реакции (1) равен M(H2SO4) =98 г/моль, а в реакции (2) -M(H2SO4)/2=49 г/моль. Эквивалент Al(ОН)3в реакции (4) - M(Al(OH)3)/3, а в реакции (3) –M(Al(OH)3)/1.
Задача 13.Вычислить эквивалент H3РO4в реакциях с раствором КОН с образованием КH2РO4; К2HРO4; К3РO4.
Решение.
1) КОН + H3РO4 = КH2РO4 + H2O
Образуется 1 молекула H2O, т.е. в H3РO4 замещается 1 атом водорода, поэтому Э (H3РO4) = М (H3РO4)/ 1 = 98/1 = 98 г/моль
2) 2КОН + H3РO4 = К2HРO4 + 2 H2O
Образуется 2 молекулы H2O, т.е. в H3РO4 замещается 2 атома водорода, поэтому Э (H3РO4) = М (H3РO4)/ 2 = 98/2 = 49 г/моль
3) 3КОН + H3РO4 = К3РO4 + 3 H2O
Образуется 3 молекулы H2O, т.е. в H3РO4 замещается 3 атома водорода, поэтому Э (H3РO4) = М (H3РO4)/ 3 = 98/3 = 32,67 г/моль
Задача 14. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода, измеренного при н.у. Вычислите эквивалент и атомный вес металла.
Решение. Схема реакции:
3,24 г4,03 л
Ме + кислота → соль + Н2
Э (Ме) ЭV (Н2) = 11,2 л
По закону эквивалентов:
m (Ме) - V (Н2)
Э (Ме) - ЭV (Н2)
Откуда: Э (Ме) = 3,24 г * 11,2 л / 4,03 л = 9 г/моль
Валентность металла равна 3.Атомный вес металла:
А (Ме) = Э (Ме) * В (Ме) = 9*3 = 27 г/моль.
Ответ: это – алюминий.
Задача 14. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквиваленты металла и его оксида.
Решение:
m (Ме2О) = 2,48 г
m (Ме) = 1,84 г
m (О) = 2,48 - 1,84 = 0,64 г
По закону эквивалентов:
m (Ме) - m (О)
Э (Ме) - Э (О)
Известно, что эквивалент кислорода равен 8 г/моль, следовательно:
Э (Ме) = (1,84 г* 8 г/моль)/ 0,64 г = 23 г/моль.
М (Ме) = Э (Ме)*В = 23 г/моль; это - натрий
Э (Ме2О) = Э (Ме) + Э (О) = 23 + 8 = 31 г/моль
Ответ: Эквивалент металла – 23 г/моль; эквивалент оксида металла – 31 г/моль.
Задача 15. Оксид трехвалентного элементасодержит 31,58% кислорода. Вычислите эквивалент и атомную массу этого элемента.
Решение: Масса элемента: 100 – 31,58 = 68,42 %
Эквивалент кислорода равен 8 г/моль
По закону эквивалентов:
m (Э) - m (О)
Э (Э) - Э (О)
Э (Э) = m (Э)* Э (О) / m (О) = (68,42 в.ч. *8 г/моль)/31,58 в.ч. = 17,332 г/моль;
М (Э) = Э (Э)*В = 17,332 г/моль * 3 = 52 г/ моль
Ответ: Эквивалент элемента равен 17,332 г/моль, атомная масса элемента равна 52 г/моль.
Задача 16. При сгорании серы в кислороде образовалось 12,8 г SO2. Сколько эквивалентов кислорода требуется на эту реакцию? Чему равны эквиваленты серы и ее оксида.
Решение: 1. S + O2 ®SO2
m (SO2) = 12,8 г
2. Эквивалентная масса кислорода постоянна и равна 8 г/моль. В реакции:
из 32 г/моль O2 получается 64 г/моль SO2
а из х г O2 получается 12,8 г SO2
m (О2) = 32*12,8 / 64 = 6,4 г
Следовательно, в реакцию вступило: n = 6,4 г/ 8 г/моль = 0,8 моль эквивалентов O2.
3. Э (SO2) = М (SO2)/ ВS* nS = 64 г/моль / (4*1) = 16 г/моль
Эквивалент SO2 = 16/64 = ¼ моль
4. Эквивалент серы определим из пропорции:
32 г серы соединяются с 32 г кислорода,
а Э серы - « - « - « - 8 г/моль кислорода
Э (S) = 8 г/моль
Эквивалент серы равен ¼ моль.
Ответ: Эквиваленты серы и ее оксида равны ¼ моль.
Задача 17. На нейтрализацию 1 г кислоты израсходовано 1,247 г КОН. Вычислить эквивалентную массу кислоты.
Решение:схема уравнения реакции:
1 г 1,247 г
Кислота + КОН
Э (кислоты) Э (КОН) = 56/1 г/моль-экв
Составляем пропорцию:
1 г кислоты – « - « - 1,247 г КОН
Э кислоты – « - « - 56 г/моль КОН
Экислоты = 1*56/1,247 = 44,91 г/моль
Ответ: эквивалентная масса кислоты равна 44,91 г/моль.
Задача 18. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение: 1.Схема уравнения реакции:
3,24 г14,7 гV л
Ме + H2SO4 → МеSO4 + Н2
Э (Ме) Э = 98/2 49 г/моль ЭV (Н2) = 11,2 л
2. По закону эквивалентов:
m (H2SO4) - V (Н2)
Э (H2SO4) - ЭV(Н2)
V(Н2) = (14,7 г * 11,2 л/моль) / 49 г/моль = 3,36 л
3. Эквивалент металла определяется из пропорции на основании закона эквивалентов:
m (Ме) - m (H2SO4)
Э (Ме) - Э (H2SO4)
Э (Ме) = (3,24 г* 49 г/моль) / 14,7 г = 56 г/моль
Ответ: эквивалентная масса металла равна 56 г/моль; объем выделившегося водорода при н.у. равен 3,36 л.
Задача 19. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквиваленты металла и его оксида. Чему равна атомная масса металла?
Решение: 1. Схема уравнения реакции:
16,74 г21,54 г
Ме + O2 → МеO
Э (Ме) Э (О) = 8 г/моль
2. Масса кислорода, вступившая в реакцию:
21,54 г – 16,74 г = 4,8 г
3. По закону эквивалентов:
m (Ме) - m (O)
Э (Ме) - Э (O)
Э (Ме) = (16,74 г* 8 г/моль) / 4,8 г = 27,9 г/моль
4. Атомная масса металла:
М (Ме) = Э (Ме)*В = 27,9*2 = 55,8 г/моль.
5. Эквивалент оксида:
Э (МеО) = Э (Ме) + Э (О) = 27,9 + 8 = 35,9 г/моль
Ответ: Эквивалент металла – 27,9 г/моль; эквивалент оксида металла – 35,9 г/моль; атомная масса металла - 55,8 г/моль.
Задача 20. Вещество содержит 39,0% серы, эквивалентная масса которой 16, и мышьяк. Вычислите эквивалентную массу и валентность мышьяка. Составьте формулу этого вещества.
Решение:1.Обозначим искомую формулу:
AsxSy
2. m (S) = 39 % ®m (As) = 100 – 39 = 61 %
Э (S) = 16 г/моль; Э (As) = х
3. По закону эквивалентов:
Э (As) = 16,0 * 61 в.ч./ 39 в.ч. = 25,0 г/моль
4. Валентность мышьяка: В (As)= М(As)/ Э (As) = 75/25 = 3,
Следовательно, формула соединения:
As2S3
Ответ: эквивалентная масса мышьяка – 25 г/моль, валентность мышьяка равна трем.
Электронная структура атомов
Положение электрона вокруг ядра атома можно описать с помощью квантовых чисел: n, l, ml, ms
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах. n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых, l имеет буквенные обозначения:
| l | = | 0 | 1 | 2 | 3 | 4 |
| l | = | s | p | d | f | g |
Электроны с одинаковым значением l образуют подуровень.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений (табл. 1).
Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p-орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены.
Таблица 1 - Число орбиталей с данным значением l
| Орбитальное квантовое число | Магнитное квантовое число | Число орбиталей с данным значением l |
| l | ml | 2l + 1 |
| 0 (s) | 0 | 1 |
| 1 (p) | –1, 0, +1 | 3 |
| 2 (d) | –2, –1, 0, +1, +2 | 5 |
| 3 (f) | –3, –2, –1, 0, +1, +2, +3 | 7 |
Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установлено, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось.
Электроны с разными ms обозначаются стрелками, направленными вверх  и вниз
и вниз  Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения на какую-либо ось координат (обычно ось z).Пространственное расположение электронных орбиталей представлено на рис. 1
Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения на какую-либо ось координат (обычно ось z).Пространственное расположение электронных орбиталей представлено на рис. 1
В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырех квантовых чисел, однако в этом случае электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, а вернее их суммой.
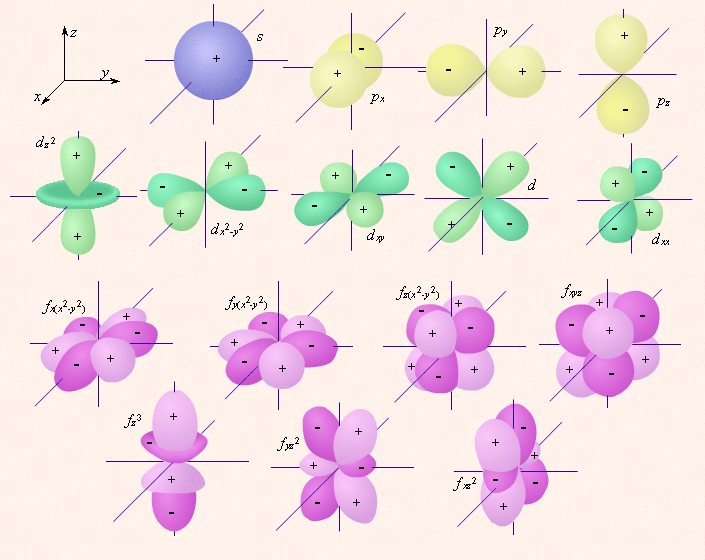
Рисунок 1- Пространственное расположение электронных орбиталей
По правилу Клечковского:энергия атомных орбиталей возрастает по мере увеличения суммы n + l.
При одинаковой сумме сначала заполняется уровень с меньшим n и большим l. Энергия атомных орбиталей возрастает согласно ряду:
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s ≈ 5f ≈ 6d < 7p.
Заселение электронами атомных орбиталей (АО) осуществляется согласно правилу Клечковского, принципу наименьшей энергии, принципу Паули и правилу Гунда.
Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии элекронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Принцип Паули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме (или молекуле, или ионе) должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2l + 1 орбитали, на которых размещаются не более 2(2l + 1) электронов. Отсюда следует, что емкость s-орбиталей – 2, p-орбиталей – 6, d-орбиталей – 10 и f-орбиталей – 14 электронов. Если число электронов при заданном l просуммировать от 0 до n – 1, то получим формулу Бора–Бьюри, определяющую общее число электронов на уровне с заданным n:
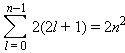
Эта формула не учитывает межэлектронное взаимодействие и перестает выполняться при n ≥ 3.
Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правилом Гунда: наименьшей энергией обладает электронная конфигурация с максимальным спином. Это означает, что если на p-орбитали три электрона, то они располагаются так: 

 , и суммарный спин S = 3/2, а не так:
, и суммарный спин S = 3/2, а не так: 

 , S = 1/2.
, S = 1/2.
Задача 1.Какое состояние атома называется основным, и какое – возбужденным? Чем ион отличается от нейтрального атома? Изобразите электронные формулы и схемы атома серы в основном и возбужденном состояниях, а также ионов S+4 и S-2.
Решение:
Атом не излучает и не поглощает энергию при движении электронов только по определенным (стационарным орбитам). Такое состояние атома называется устойчивым.
При поглощении атомом энергии он переходит из нормального (основного) в возбужденное состояние. При этом электроны удаляются от ядра, «перескакивая» на более дальние стационарные орбиты.
Размещение электронов по АО в пределах одного энергетического подуровня определяется правилом Хунда (суммарный спин данного подуровня должен быть максимальным). При любом другом размещении электронов атом будет находиться в возбужденном состоянии.
16S – 1s22s22p63s23p4 p-элемент
s p d
| n=3 | ↑↓ | ↑↓ | ↑ | ↑ | |||||
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| n=1 | ↑↓ |
Основное состояние; В=2 (число неспаренных электронов)
При возбуждении:
S + hν → S*
16 S*
S p d
| n=3 | ↑↓ | ↑ | ↑ | ↑ | ↑ |
В=4
16 S*
S p d
| n=3 | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ |
В=6
Ион от нейтрального атома отличается числом электронов.
S0 - 4 e → S+4
S+4 - 1s22s22p63s23p0
S p d
| n=3 | ↑↓ |
S0 + 2 e → S-2
S-2 - 1s22s22p63s23p6
S p d
| n=3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
Задача 2.Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных 3d орбиталей в атомах этих элементов.
Решение:Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии электронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Энергия атомных орбиталей возрастает согласно ряду:
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s ≈ 5f ≈ 6d < 7p
Тогда:
21Sc– 1s22s22p63s23p64s23d1 – d-элемент
23Mo - 1s22s22p63s23p64s23d3 - d-элемент
d-орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве.
Каждый подуровень содержит 2l + 1 орбитали.
Отсюда - 5 d-орбиталей.
S pd
| n=4 | ↑↓ | ||||||||
| n=3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ||||
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| n=1 | ↑↓ |
21Sc– 4 свободных 3d орбиталей
S p d
| n=4 | ↑↓ | ||||||||
| n=3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | |||
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| n=1 | ↑↓ |
23Mo - 3 свободных 3d орбиталей
Задача3.Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s – электрона на 4d –подуровень. К какому электронному семейству каждый из этих элементов.
Решение:
32Ge– 1s22s22p63s23p64s23d104p2 – р-элемент
42Mo- 1s22s22p63s23p64s23d104p65s14d5 -d-элемент
Задача 4.Написать электронные формулы ионов:Sn2+, Sn4+, Mn2+, Cr3+, S2-.
Решение: а) электронная формула олова:
50Sn - 1s22s22p63s23p64s23d104p65s24d105p2 - p -элемент
Sn - 2 ê = Sn2+
Отсюда, электроннаяформулаSn2+:
Sn2+ - 1s22s22p63s23p64s23d104p65s24d105p0
Б) Sn - 4 ê = Sn4+
ЭлектроннаяформулаSn4+:
Sn4+ - 1s22s22p63s23p64s23d104p65s04d105p0
В) 25Mn - 1s22s22p63s23p64s23d5 d- элемент
Mn - 2 ê = Mn2+
Mn2+ - 1s22s22p63s23p64s03d5
Г) 24Cr - 1s22s22p63s23p64s23d4
Cr0 – 3e = Cr3+
Cr3+ - 1s22s22p63s23p64s03d3
Д) 16S0 - 1s22s22p63s23p4
S0 + 2 e → S-2
S-2 - 1s22s22p63s23p6
Задача 5. Напишите электронные конфигурации в основном состоянии следующих элементов: C, Al, Fe, La.
Решение:А) 6С - 1s22s22p2
Распределение электронов в основном состоянии можно представить в виде квантовых ячеек:
S p
| n=2 | ↑↓ | ↑ | ↑ | |
| n=1 | ↑↓ |
Число неспаренных электронов равна 2, поэтому валентность углерода в основном состоянии В=2.
Б) 13Al - 1s22s22p63s23p1р-элемент
S p d
| n=3 | ↑↓ | ↑↓ | |||||||
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| n=1 | ↑↓ |
В) 26Fe - 1s22s22p63s23p64s23d6 d –элемент
S p d
| n=4 | ↑↓ | ||||||||
| n=3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| n=1 | ↑↓ |
Г) La - 1s22s22p63s23p64s23d10 4p65s24d105p66s25d1 d -элемент
S p df
| n=6 | ↑↓ | |||||||||||||||
| n=5 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | |||||||||||
| n=4 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
Задача 6.Структура валентного электронного слоя атома элемента выражается формулой: a) 5s25p4; б) 3d54slв) 6s1. Определите порядковый номер и название элемента.
Решение:a) 5s25p4
Главное квантовое число n = 5, следовательно, V период;
2е + 4е = 6е - VI группа, главная подгруппа.
Te – теллур
б) 3d5 4sl
n = 4
Дата добавления: 2018-04-15; просмотров: 489; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
