Способы выражения растворенного вещества в растворе
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.К безразмерным концентрациям (долям) относятся следующие концентрации:
Массовая доля растворенного вещества W(B) выражается в долях единицы или в процентах:
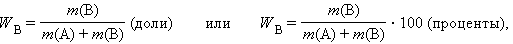
где m(B) и m(A) – масса растворенного вещества B и масса растворителя A.
Объемная доля растворенного вещества σ(B) выражается в долях единицы или объемных процентах:

где Vi – объем компонента раствора, V(B) – объем растворенного вещества B. Объемные проценты называют градусами. Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн–1), ppm.
Мольная доля растворенного веществаχ(B) выражается соотношением:
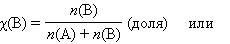
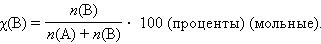
Сумма мольных долей k компонентов раствора χi равна единице:
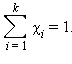
К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества Cm(B) определяется количеством вещества n(B) в 1 кг (1000 г) растворителя, размерность моль/кг.
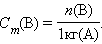
Молярная концентрация вещества B в растворе C(B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр:
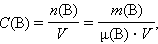
где μ(B) – молярная масса B, V – объем раствора.
Молярная концентрация эквивалентов вещества (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:
|
|
|

где nЭ(B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
Титр раствора вещества B(TB) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
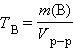 г∙мл–1 или
г∙мл–1 или
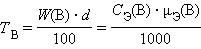 г∙мл–1
г∙мл–1
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Задача 1. Найдите массовую долю этанола в водном растворе спирта, в котором содержание кислорода как элемента составляет 50%.
Решение: 1. Определим массовые доли кислорода в этаноле и в воде.
%О (вода): 16/18 = 88,88 ≈ 89%
%О (этанол- С2Н5ОН): 16/46 = 34,78 ≈ 35%
2. Используем метод креста. Расставим их согласно правилу:
этанол (wo%) 35 39
смесь (wo%) 50
вода (wo%) 89 15
Находя разницу по диагонали, получим отношение масс при смешении.
Полученные значения показывают, что этанол с водой необходимо смешать в массовом соотношении 39:15.
Отсюда, массовая доля этанола равна 39/(39+15)=0,722 или 72,2%.
Задача 2. Какую массу 5% раствора сульфата меди и медного купороса CuSO4*5H2O необходимо взять для получения 400 г 10% раствора сульфата меди?
Решение:
Оптимальный способ решения данной задачи - правило креста. Для использования данного способа необходимо определить массовую долю сульфата меди в кристаллогидрате: w=160/250=0,64.
|
|
|
Далее расположим полученные данные в виде креста
5 % р-р 5 54
смесь 10
СuSO4*5H2O 64 5
Находя разницу по диагонали, получим отношение масс при смешении. Таким образом, масса кристаллогидрата будет равна:
w (СuSO4*5H2O) *400 = 54/(54+5) * 400= 366,1 г.
Следовательно, масса 5 % раствора будет равна 400 - 366,1 = 33,9 г
Ответ: для получения 400 г 10% раствора сульфата мединеобходимо взять366,1 гкристаллогидрата и 5 % растворасульфата меди.
Задача 3. Какие массы 96% и 10% серной кислоты необходимо взять для получения 400 г 40% серной кислоты?
Решение:
Вариант 1.Наиболее простым способом для решения задач подобного типа является правило креста:
96 30
40
10 56
30: 56 или 15:28 (на 15 массовых частей 96% серной кислоты нужно взять 28 частей 10% кислоты).
Т.е. 15x + 28x=400 ®43x=400, x=9,3.
Масса 96% серной кислоты равна 15*9,3=139,5;
Масса 10% серной кислоты равна: 28*9,3=260,5.
Вариант 2. Рассмотрим способ решения этой задачи через введение двух неизвестных.
Однако, в данном случае, удобнее оперировать с массами. Примем массу 96% серной кислоты за x, а 10% - за y.
Тогда, из определения массовой доли получим:
|
|
|
0,4=(0,96x + 0,10y)/(x + y) ® 0,4x + 0,4y = 0,96x + 0,10y ®
0,30y = 0,56x.
C другой стороны x + y = 400.
Получив систему уравнений 0,30y = 0,56x
y = 400 - x,
решим ее:
0,3 *(400 - x) = 0,56x ® 120 - 0,3x = 0,56x ®0,86x = 120 ® x=139,5, что вполне согласуется с ответом, полученным при решении задачиметодом креста.
Ответ: для получения 400 г 40% серной кислотынеобходимо взять139,5 г96% серной кислоты и 260,5 г10% серной кислоты.
Задача4. Вычислите нормальность следующих растворов:
а) 60%-ного растворв уксусной кислоты (ρ =1,068 г/см3), б) 49%-ного раствора Н3РО4 (ρ =1,338 г/см3).
Решение:1. Эквивалентная концентрация (или нормальность) Сн - число моль эквивалентов растворенного вещества, содержащегося в 1 л раствора. Эквивалентную концентрацию определяют по формуле:
Сн = m / Э* v
2. Массу растворенного вещества определим следующим образом:
в 100 г 60%-ного раствора СН3СООН содержится 60 г СН3СООН
а в 100 г 49%-ного раствора Н3РО4 содержится 49 г Н3РО4 безводной
3. С учетом плотностей растворов определяем содержание безводных кислот в 1 литре раствора:
ρ = m/v → v = m/ ρ
а) 100 г : 1,068 г/ см3 = 92,6 см3
в 92,6 см3 - 60 г СН3СООН
в 1000 см3 - х г СН3СООН
х = 60*1000 /92,6 = 648 г/л
б) 100 г : 1,338 г/ см3 = 74,74 см3
в 74,74 см3 - 49 г Н3РО4 г
|
|
|
в 1000 см3 - х г Н3РО4 г
х = 49*1000 / 74,74 = 655,6 г/л
4. Определяем эквивалентные массы кислот:
а) Э СН3СООН = М СН3СООН /1 = 60 г/ моль-экв
б) Э Н3РО4 = МН3РО4 /3 = 98/3 = 32,667 г/моль-экв
5. Нормальная концентрация растворов:
а) Сн = 648 г/л : 60 г/моль-экв = 10,8 н.
б) Сн = 655,6 г/л : 32,667 г/моль-экв = 20 н.
Задача5.На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите молярную концентрацию эквивалента раствора кислоты.
Решение:Определяем концентрацию раствора КОН:
М(КОН)= 56 г/моль
Э(КОН) = М(КОН) / 1 = 56 г/моль
N(КОН) =1,4 г/л : 56 г/моль = 0,025 моль-экв/л = 0,025 н
- По закону эквивалентов:
N1V1 = N2V2;
отсюда, молярная концентрация эквивалента раствора кислоты равна: N2 = N1V1 / V2 = 1000 мл * 0,025 н. / 50 мл = 0,5 н.
Ответ: молярная концентрация эквивалента раствора кислоты равна 0,5 моль-экв/л.
Задача6. Чему равна молярная концентрация эквивалента 30% раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды.Вычислите массовую долю полученного раствора.
Решение:
1) 30% раствор означает, что в растворе содержится 30 % NaOH безводной.
1 л 30% раствора NaOH весит:
m = V*ρ = 1 см3*1,328 г/см3 = 1328 г
тогда масса NaOH:
1328 г * 30% /100% = 398,4 г
2) При прибавлении 5 л воды масса вновь полученного раствора составит:
5000 г + 1328 г = 6328 г
3) Массовая доля полученного раствора:
398,4 г/ 6328 г * 100% = 0,063 *100% = 6,3%
4) Эквивалентная масса NaOH:
Э = М(NaOH)/1 = 40 г/моль
5) Молярная концентрация эквивалента 30% раствора NaOH составит:
398,4 г/см3 /40 г/моль = 9,96 моль/см3 = 9,96 н
Ответ: 6,3 %; 9,96 н
По второму закону Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:

По определению, при Cm(В) = 1 моль/кг повышение температуры ΔТ равно Кэб– эбулиоскопической константе для данного растворителя.
Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:

Понижение температуры замерзания определяется аналогично:
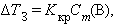
где Kкр – криоскопическая константа.
Задача7.Вычислите массовую долю (%) водного раствора глюкозы С6Н12О6, зная, что этот раствор кипит при 100,260С. Эбуллиоскопическая константа воды 0,520.
Решение:1.Температура кипения чистой воды 1000С. Повышение температуры кипения при добавлении глюкозы: ∆ Т = 100,26 – 100 = 0,260 С.
2. По закону Рауля повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя выражается уравнением: ∆ Т = Кэб m; отсюда, моляльность раствора:
m = ∆ Т/ Кэб = 0,26: 0,52 = 0,5 моль/кг
3. Моляльность – число моль растворенного вещества на 1 кг растворителя.
М(С6Н12О6) = 180 г/моль;
Отсюда масса растворенного вещества на 1000 г растворителя :
180 г/моль * 0,5 моль/кг = 90 г / кг
4. Масса раствора 90 г + 1000 г = 1090 г
в 1090 г раствора содержится 90 г глюкозы,
а в 100 г раствора –« - « - « - х г глюкозы
х = (100*90)/ 1090 = 8,25 г
Ответ: 8,25 %.
Задача8.При растворении хлороформа массой 15 г в диэтиловом эфире массой 400 г температура кипения последнего повысилась на 0,6350 С. Вычислить молярную массу хлороформа. Эбуллиоскопическая константа эфира равна 2,02 град.
Решение:
- Кэб= ∆ Ткип / m, где m –моляльная концентрация раствора.
- Моляльность – число моль растворенного вещества содержащегося в 1 кг растворителя.
- Число моль растворенного вещества определяется по формуле:
ν = m / M
Отсюда, моляльность раствора:
m = Кэб /∆ Т кип = 2,02 : 0,635 = 3,11моль/кг
15 г хлороформа - на 400 г эфира
х г хлороформа - на 1000 г эфира
х = 15*1000/400 = 37,5 г/кг
М = ν * m = 37,5 *3,11=116,625 г/моль
Можно использовать формулу:
М= (1000* Кэб *g ) /(g0 *∆ Ткип) =(1000 *2,02*15) /(400 * 0,635) = 116,5 г/моль
Где g – масса растворенного вещества
g0- масса растворителя.
Ответ: молярная масса хлороформа равна 116,5 г/моль.
Задача 9.Раствор, содержащий 3,04 г камфары C10H16O в 100 г бензола, кипит при 80,7140 С. Температура кипения бензола – 80,20С. Вычислите эбуллиоскопическую константу бензола.
Решение:
|
ΔT |
= К | m*1000 |
|
| M* m1 |
где m = 3,04 г; m1 = 100 г; М (C10H16O) = 152 г/моль
ΔT = 80,7140 - 80,20 = 0,514 0С
|
Кэб |
= | ΔT *M m1 |
|
| m*1000 |
Кэб = (0,514 *152*100) / (3,04*1000) = 2,570
Ответ: эбуллиоскопическая константа бензола равна 2,570
Растворы слабых электролитов
Растворение некоторых веществ сопровождается высвобождением или образованием ионов.Важной характеристикой электролитов служит степень диссоциации α:

По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, α > 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Равновесная реакция диссоциации слабого электролита HAn:
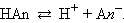
Константа равновесия Kр этой реакции и есть Kд:
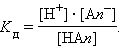
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим:
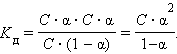
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:
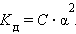
Тогда
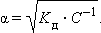
при бесконечном разбавлении степень диссоциации α стремится к единице.
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой.
Задача 1. Напишите реакции ступенчатой диссоциации ортофосфорной кислоты:
Решение: трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом:
| Реакция | Константа диссоциации Kд | Степень диссоциации α |
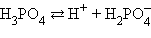
| 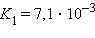
| α = 27 % |

| 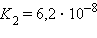
| α = 0,15 % |

| 
| α = 0,005 % |
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
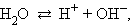
ее константа при 298 K равна:

При столь малой константе диссоциации концентрация воды остается практически неизменной и равной:

Отсюда произведение постоянных величин:
Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна:
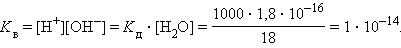
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде:
[H+] = [OH–] = 1 ∙ 10–7,
при [H+] > 1 ∙ 10–7 – кислой,
при [H+] < 1 ∙ 10–7 – щелочной.
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3).
Задача 2. Вычислите pH0,1 М раствора синильной кислоты. КНСN= 7,9*10-10.
Решение:
1. pH = - lg [H+]
2. [H+] = С*α
3. 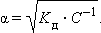
Решаем задачу в обратном порядке:
α = √(7,9*10-10 * 10-1) = √ 79*10-12 = 8,89 *10-6
[H+] = 10-1* 8,89 *10-6 = 8,89 *10-7
pH = - lg8,89 *10-7 = - 0,9489 + 7 = ≈ 6,05
Дата добавления: 2018-04-15; просмотров: 376; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
