Задачи для самостоятельного решения
Задача 1.Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 28. К какому электронному семейству относится каждый из этих элементов?
Задача 2.Составьте электронную формулу атома элемента с порядковым номером 25.
Покажите распределение валентных электронов в нормальном и возбужденном состояниях. Какие степени окисления возможны у этого элемента?
Задача 3.Какие элементы в периодической системе носят названия s-, p-, d-, f-элементов? Приведите примеры.
Задача 4. Какие значения могут принимать квантовые числа п, I, тги ms, характеризующие состояние электронов в атоме. Какие значения они принимают для внешних электронов атома магния?
Электронные конфигурации атомов элементов периодической системы представлены в табл.2.
Таблица 2 - Электронные конфигурации атомов
| Z | Символ элемента | Электронная конфигурация | Z | Символ элемента | Электронная конфигурация |
| 1 | H | 1s1 | 39 | Y | 4d15s2 |
| 2 | He | 1s2 | 40 | Zr | 4d25s2 |
| 3 | Li | [He]2s1 | 41 | Nb | 4d45s1 |
| 4 | Be | 2s2 | 42 | Mo | 4d55s1 |
| 5 | B | 2s22p1 | 43 | Tc | 4d55s2 |
| 6 | C | 2s22p2 | 44 | Ru | 4d75s1 |
| 7 | N | 2s22p3 | 45 | Rh | 4d85s1 |
| 8 | O | 2s22p4 | 46 | Pd | 4d105s0 |
| 9 | F | 2s22p5 | 47 | Ag | 4d105s1 |
| 10 | Ne | 2s22p6 | 48 | Cd | 4d105s2 |
| 11 | Na | [Ne]3s1 | 49 | In | 4d105s25p1 |
| 12 | Mg | 3s2 | 50 | Sn | 4d105s25p2 |
| 13 | Al | 3s23p1 | 51 | Sb | 4d105s25p3 |
| 14 | Si | 3s23p2 | 52 | Te | 4d105s25p4 |
| 15 | P | 3s23p3 | 53 | I | 4d105s25p5 |
| 16 | S | 3s23p4 | 54 | Xe | 4d105s25p6 |
| 17 | Cl | 3s23p5 | 55 | Cs | [Xe]6s1 |
| 18 | Ar | 3s23p6 | 56 | Ba | 6s2 |
| 19 | K | [Ar]4s1 | 57 | La | 5d16s2 |
| 20 | Ca | 4s2 | 58–71 | Ln (Ce–Lu) | 4f 2–145d 0–16s 2 |
| 21 | Sc | 3d14s2 | 72 | Hf | 5d26s2 |
| 22 | Ti | 3d24s2 | 73 | Ta | 5d36s2 |
| 23 | V | 3d34s2 | 74 | W | 5d46s2 |
| 24 | Cr | 3d54s1 | 75 | Re | 5d56s2 |
| 25 | Mn | 3d54s2 | 76 | Os | 5d66s2 |
| 26 | Fe | 3d64s2 | 77 | Ir | 5d76s2 |
| 27 | Co | 3d74s2 | 78 | Pt | 5d96s1 |
| 28 | Ni | 3d84s2 | 79 | Au | 5d106s1 |
| 29 | Cu | 3d104s1 | 80 | Hg | 5d106s2 |
| 30 | Zn | 3d104s2 | 81 | Tl | 5d106s26p1 |
| 31 | Ga | 3d104s24p1 | 82 | Pb | 5d106s26p2 |
| 32 | Ge | 3d104s24p2 | 83 | Bi | 5d106s26p3 |
| 33 | As | 3d104s24p3 | 84 | Po | 5d106s26p4 |
| 34 | Se | 3d104s24p4 | 85 | At | 5d106s26p5 |
| 35 | Br | 3d104s24p5 | 86 | Rn | 5d106s26p6 |
| 36 | Kr | 3d104s24p6 | 87 | Fr | [Rn]7s1 |
| 37 | Rb | [Kr]5s1 | 88 | Ra | 7s2 |
| 38 | Sr | 5s2 | 89 | Ac | 5d17s2 |
|
|
|
Периодическая система элементов. Основные классы неорганических соединений
Исследуя изменение химических свойств элементов в зависимости от величины их относительной атомной массы (атомного веса), Д. И. Менделеев в 1869 г. открыл закон периодичности этих свойств: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомных весов элементов».
Физическая основа периодического закона была установлена в 1922 г. Н. Бором. Поскольку химические свойства обусловлены строением электронных оболочек атома, периодическая система Менделеева – это естественная классификация элементов по электронным структурам их атомов. Простейшая основа такой классификации – число электронов в нейтральном атоме, которое равно заряду ядра. Но при образовании химической связи электроны могут перераспределяться между атомами, а заряд ядра остается неизменным, поэтому современная формулировка периодического закона гласит: «Свойства элементов находятся в периодической зависимости от зарядов ядер их атомов».
|
|
|
Это обстоятельство отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп.
Период – горизонтальный ряд, имеющий одинаковое число электронных слоев, номер периода совпадает со значением главного квантового числа n внешнего уровня (слоя); таких периодов в периодической системе семь. Второй и последующие периоды начинаются щелочным элементом (ns1) и заканчивается благородным газом (ns2np6).
По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – А, состоящие из s- и p-элементов, и побочные – B-подгруппы, содержащие d-элементы. Подгруппа III B, кроме d-элементов, содержит по 14 4f- и 5f-элементов (4f- и 5f-семейства). Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы.
|
|
|
В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на s- и p-орбиталях внешнего энергетического уровня, в побочных – на s-орбиталях внешнего и d-орбиталях предвнешнего слоя. Для f-элементов валентными являются (n – 2)f- (n – 1)d- и ns-электроны.
Сходство элементов внутри каждой группы – наиболее важная закономерность в периодической системе. Следует, отметить такую закономерность, как диагональное сходство у пар элементов Li и Mg, Be и Al, B и Si и др. Эта закономерность обусловлена тенденцией смены свойств по вертикали (в группах) и их изменением по горизонтали (в периодах).
Таким образом, структура электронной оболочки атомов элемента изменяется периодически с ростом порядкового номера элемента. С другой стороны, свойства определяются строением электронной оболочки и, следовательно, находятся в периодической зависимости от заряда ядра атома.
Атомный радиус. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента.
|
|
|
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
Задача 1.Исходя из положения металла в периодической системе, определите, какой из двух гидроксидов является более сильным основанием:
а)Mg(OH)2 или Be(OH)2, б) Cd(OH)2 или Sn(OH)2, в) Sr(OH)2 или Mo(OH)2?
Решение:
С увеличением порядкового номера в группах сила оснований возрастает, поэтому Mg(OH)2 как основание сильнее Be(OH)2.
С увеличением порядкового номера в периодах сила оснований ослабевает, а сила кислот возрастает, поэтому Cd(OH)2 сильнее Sn(OH)2, а Sr(OH)2 сильнее Mo(OH)2.
Эмпирическая формула составляется из атомных символов элементов, записываемых в определенном порядке друг за другом.
Катион в формулах солей всегда ставится на первое место: MgCl2, KMnO4, (NH4)2CO3.
Если соль содержит более одного катиона или более одного аниона, то в формуле они записываются в алфавитном порядке их символов: KCr(SO4)2, PtBr2Cl2.
В бинарных соединениях на первое место ставиться тот элемент, электроотрицательность которого ниже.
Электроотрицательность (ЭО) – способность атома оттягивать на себя электрон в химическом соединении.
В основу электроотрицательности положены следующие физические обоснования (шкалы):
Шкала Полинга базируется на энергии связи при образовании сложного вещества из простых.
Шкала Малликена – ЭО пропорциональна полуразности первого потенциала ионизации и сродства к электрону ЭО ~ 0,5 ∙ (I1 + Eср).
Шкала Олреда–Рохова основана на электростатической силе, действующей на внешний электрон.
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
Относительная электроотрицательность атомов представлена в табл. 3.
Таблица 3 - Значения электроотрицательности важнейших элементов
| Н 2,1 | ||||||
| Li 0,98 | Be 1,5 | В 2,0 | С 2,5 | N 3,07 | 0 3,5 | F 4,0 |
| Na 0,93 | Mg 1,2 | Al 1,6 | Si 1,9 | P 2,2 | S 2,6 | Cl 3,0 |
| К 0,91 | Ca 1,04 | Ga 1,8 | Ge 2,0 | As 2,1 | Se 2,5 | Br 2,8 |
| Rb 0,89 | Sr 0,99 | In 1,5 | Sn 1,7 | Sb 1,8 | Те 2,1 | I 2,6 |
Задача 2.Составьте формулы бинарных соединений, образованных кислородом и кальцием, кислородом и серой, фтором и кислородом.
Решение. В бинарных соединениях на первое место ставиться тот элемент, электроотрицательность которого ниже. При этом валентность первого элемента равна номеру группы элемента в периодической системе Менделеева, валентность второго элемента равна 8 - № группы.
| Ca | О | Скелет формулы | Молекулярная формула |
| χ = 1,04 | χ = 3,5 | CaО | CaІІ ОVІІІ-VІ |
| № группы = 2 | № группы = 6 | CaО | |
| О | S | Скелет формулы | Молекулярная формула |
| χ = 3,5 | χ = 2,6 | SО | S VІ ОVІІІ-VІ |
| № группы = 6 | № группы = 6 | SО3 | |
| О | F | Скелет формулы | Молекулярная формула |
| χ = 3,5 | χ = 4,0 | ОF | ОІІ FVІІІ-VІІ |
| У кислорода нет свободных орбиталей, поэтому его валентность в соединениях не более 2 | № группы = 7 | ОF2 |
Кислоты рассматриваются как соли протона H+: HCl, H2SO4, H3PO4.
Основания – соединения, у которых анионом служит гидроксил-ион OH–: KOH, Al(OH)3.
Важнейшие классы неорганических соединений представлены на рис. 2.

Рисунок 3 - Классы неорганических соединений
Задача 3. Напишите формулы оксидов, соответствующих указанным гидроксидам: Н2SiO3; Cu(OH)2; H3AsO4; H2WO4; Fe(OH)3.
Решение.
| Гидроксид | Оксид |
| Н2Si+4O3 | Si+4O2 |
| Cu+2(OH)2 | Cu+2O |
| H3As+5O4 | As2+5O5 |
| H2W+6O4 | W+6O3 |
| Fe+3(OH)3 | Fe2+3O3 |
Задача 4.Исходя из положения германия и технеция в периодической системе, составьте формулы мета- и ортогерманиевой кислот, и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
Решение:32Ge - 1s22s22p63s23p64s23d10 4p2 - p-элемент
S p d
| n= 4 | ↑↓ | ↑ | ↑ |
В возбужденном состоянии:
S p d
| n= 4 | ↑ | ↑ | ↑ | ↑ |
Число неспаренных электронов равно 4, следовательно В = 4
Высшая степень окисления - Ge+4
52Те -1s22s22p63s23p64s23d104p65s24d10 5p44f0
Высшая степень окисления - Те +6В возбужденном состоянии:
F
| s | p | ↑ | ↑ | ||||||
| n= 5 | ↑ | ↑ | ↑ | ↑ |
Формулы:
| Н - О | ||||
| мета – | Н2Ge О3 | Ge = | О | |
| Н - О |
| Н - О | |||
| орто – | Н4Ge О4 | Н - О |
Ge
|
| Н - О | |||
| Н - О |
| О | ||
| Те О3 | Те | О |
| О |
Взаимодействие химических соединений записывается с помощью химических уравнений, отражающих материальный баланс всех реагирующих веществ. Это достигается с помощью стехиометрических коэффициентов перед формулами соединений:
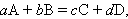
где A, B, C, D – реагирующие вещества; a, b, c, d – стехиометрические коэффициенты.
Можно выделить четыре основных типа химических реакций:
Соединения:
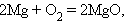
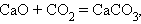
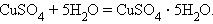
Замещения:
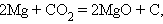
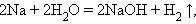
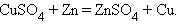
Разложения:
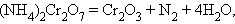
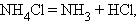
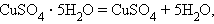
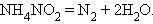
Обмена:
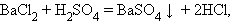
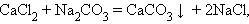
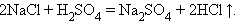
Реакции, сопровождающиеся изменением степени окисления всех или некоторых реагирующих веществ, называются окислительно-восстановительными.
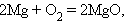
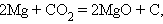
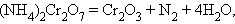
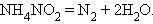
Задача 5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) Zn → K2ZnO2; б) S → H2SO3; в) Cu → CuS; г) Fe →Fe(OH)2.
Решение.
а) Zn → K2ZnO2
Zn + 2 HCl = ZnCl2+ H2↑
При добавлении избытка щелочи:
ZnCl2 + 4 KOH= K2ZnO2+ 2 KCl + 2 Н2О
б) S → H2SO3
S + О2 = SО2↑
SО2 + Н2О = H2SO3
в) Cu → CuS
Cu + О2 + 4 HCl = CuCl2 + Cl2↑ + 2 Н2О
CuCl2 + Na2S = CuS ↓ + 2 NaCl
г) Fe → Fe(OH)2
при добавлении раствора соляной кислоты:
Fe + 2 HCl = FeCl2+ H2↑
FeCl2 + 2 NaOH = Fe(OH)2↓ + 2 NaCl
Задача 6. Как доказать амфотерный характер ZnО, Cr(OH)3. Напишите уравнения реакций.
Решение. К амфотерным относятся такие оксиды и гидроксиды, которые взаимодействуют, как с кислотами, так и со щелочами.
1) ZnО – амфотерный оксид, так как растворяется, как в кислотах, так и в щелочах. При взаимодействии с кислотой он проявляет свойства основного оксида:
ZnО + 2 HCl = ZnCl2 + H2О
При взаимодействии со щелочью ZnО проявляет свойства кислотного оксида:
ZnО + 2 NaOH =Na2ZnO2+ Н2О
или:
ZnО + 2 NaOH + Н2О = Na2[Zn(OH)4]
2) Cr(OH)3 амфотерный гидроксид, так как растворяется, как в кислотах, так и в щелочах:
Cr(OH)3 + 3 HCl = CrCl3 + 3Н2О
основание
Cr(OH)3 + 3 NaOH = Na3[Cr (OH)6]
кислота
Задача 7. Какие из указанных веществ реагируют с гидроксидом натрия: HNO3; CaO; CO2; CuSO4; Cd(OH)2; P2O5? Составьте уравнения реакций.
Решение.Гидроксид натрия – сильное основание, поэтому оно будет взаимодействовать с кислотой (HNO3), кислотными оксидами (CO2;P2O5), солью (CuSO4).
CaO – основной оксид, Cd(OH)2 - основной гидроксид, поэтому они с NaOH взаимодействовать не будут.
Уравнения реакций:
1) HNO3 + NaOH = NaNO3 + Н2О
2) CO2 + NaOH = NaHCO3
гидрокарбонат натрия
CO2 + 2 NaOH= Na2CO3+ Н2О
карбонат натрия
3) CuSO4 + 2 NaOH =Cu(OH)2↓ + Na2SO4
4) P2O5 + NaOH = NaH2PO4 + Н2О
дигидрофосфатнатрия
P2O5 + 2 NaOH= Na2HPO4+ 2 Н2О
гидрофосфатнатрия
P2O5 + NaOH = Na3PO4 + 3 Н2О
орто-фосфат натрия
Задача 8. Составьте формулы нормальных (средних) и кислых солей калия и кальция, образованных: а) угольной кислотой; мышьяковистой кислотой. Напишите названия этих солей.
Решение:
а) угольная кислота
H2CO3 ↔ H+ + НCO3- - гидрокарбонат-ион
НCO3-↔ H+ + CO32- - карбонат-ион
Средние соли:
К2CO3 - карбонат калия;
CaCO3- карбонат кальция.
Кислые соли:
КНCO3 - гидрокарбонат калия;
Ca(НCO3)2 - гидрокарбонат кальция.
б) ортомышьяковистая кислота H3AsO3
H3AsO3 ↔ H+ + Н2AsO3- - дигидроарсенит-ион
Н2AsO3- ↔ H+ + НAsO32-- гидроарсенит-ион
НAsO32-↔ H+ + AsO33-- арсенит-ион
Средние соли:
К3AsO3 - арсенит калия;
Ca3(AsO3)2 - арсенит кальция;
Кислые соли:
КН2AsO3– дигидроарсенит калия;
Ca (Н2AsO3)2 - дигидроарсенит кальция;.
К2НAsO3- гидроарсенит калия;
CaНAsO3- гидроарсенит кальция.
Задача 9. Составьте формулы всех солей теоретически возможных при взаимодействии: а) Cu(OH)2 и H2SO4; б) NH4OH и H3PO4.
Решение:
а) при взаимодействии эквивалентных количеств образуется средняя соль
Cu(OH)2 + H2SO4 = CuSO4 + 2 Н2О
сульфат меди
3 NH4OH + H3PO4 = (NH4)3PO4 + 3Н2О
орто-фосфат аммония
б) при взаимодействии избытка кислоты образуется кислая соль:
Cu(OH)2 + 2 H2SO4 = Cu(НSO4)2 + 2 Н2О
гидросульфат меди
2 NH4OH + H3PO4 = (NH4)2 НPO4 + 2Н2О
гидрофосфат аммония
NH4OH + H3PO4 = (NH4)Н2PO4 + Н2О
дигидрофосфат аммония
в) при взаимодействии избытка основания или недостатка кислоты образуется основная соль
2 Cu(OH)2 + H2SO4 = (CuОН)2SO4 + 2 Н2О
дигидроксосульфат меди
Задача 10. Какие кислоты могут быть получены при непосредственном взаимодействии с водой следующих оксидов: P2O5; CO2; CrO3; SO2; NO2?
Решение:
а) P2O5 + Н2О = 2 НPO3 - метафосфорная кислота
P2O5 + 2 Н2О = Н4P2O7 - пирофосфорная кислота
P2O5 + 3 Н2О = 2 Н3PO4 - ортофосфорная кислота
б) CO2+ Н2О = Н2CO3 - угольная кислота
в) CrO3 + Н2О = Н2CrO4 - хромовая кислота
2 CrO3 + Н2О = Н2Cr2O7 - двухромовая кислота
г) SO2 + Н2О = Н2SO3 - сернистая кислота
д) 2 NO2 + Н2О = НNО3 + НNО2
азотная азотистая кислота
Задача 11. Как осуществить следующие превращения:
Zn → ZnSO4 → Zn(OH)2 → Na2ZnO2 → ZnCl2 → ZnCO3 → ZnO
Решение:
1) реакция замещения:
Zn + Н2SO4 = ZnSO4 + Н2↑
сульфат цинка
2) реакция обмена:
ZnSO4 + 2 NaOH = Zn(OH)2 + 2Н2О
гидроксид натрия гидроксид цинка
3) так как гидроксид цинка – амфотерный, то он далее растворяется в щелочах:
Zn(OH)2 + 2 NaOH = Na2ZnO2 + 2Н2О
цинкат натрия
4) Na2ZnO2 + 4 НCl = ZnCl2 + 2 NaCl + 2Н2О
5) реакция обмена:
ZnCl2+ Na2CO3 = ZnCO3 ↓ + 2 NaCl
6) реакция разложения при нагревании:
ZnCO3 = ZnO + CO2 ↑
Химическая связь
Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими атомами. При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности. Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Важнейшие виды химической связи: ионная, ковалентная, металлическая, водородная, межмолекулярная.
Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа (октет) за счет образования ионов (В. Коссель) или образования общих электронных пар (Г. Льюис).
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F.
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Задача 1. Какой характер имеют связи в молекулах NCl3, CS2, ICl5, NF3, OF2, ClF, CO2. Указать для каждой из них направление смешения общей электронной связи.
Решение:
Общая электронная пара смещается в сторону более электроотрицательного элемента. Характер связи можно определить по разности значений ЭО элементов.
Если ∆χ ≥ 2, то связь – ионная,
если 2 > ∆χ > 0 - ковалентная полярная,
если ∆χ =0 – ковалентная неполярная.
Отсюда:
N(3,0)–Cl(3,0)– ковалентная неполярная, смещения электронной пары нет.
C(2,5)-S(2,5) - ковалентная неполярная, смещения электронной пары нет.
I(2,5)– Cl(3,0) – ковалентная полярная, общая электронная пара смещена в сторону хлора, I → Cl
N(3,0) – F(4,0), ковалентная полярная, общая электронная пара смещена в сторону фтора, N → F
O(3,5) – F(4,0), ковалентная полярная, общая электронная пара смещена в сторону фтора, O → F
Cl (3,0) – F(4,0), ковалентная полярная, общая электронная пара смещена в сторону фтора, Cl → F
C(2,5) – O (3,5), ковалентная полярная, общая электронная пара смещена в сторону кислорода,C → O
Задача 2. Какой способ образования ковалентной связи называется донорно-акцепторным. Какие химические связи имеются в ионах: NH4+, BF4- ? Укажите донор и акцептор.
Решение:Химическая связь, образованная за счет пары электронов одного атома (донора) и вакантной орбитали второго атома (акцептора), называется донорно-акцепторной или донорно-акцепторным механизмом образования ковалентной связи.
| Н | Н | Н | + | |||||||||||
| │ | │ | │ | ||||||||||||
| H+ | + | : | N | ─Н | → H+ | : | N | ─Н | → | Н─ | N | ─Н | ||
| │ | │ | │ | ||||||||||||
| Н | Н | Н | ||||||||||||
|
акцептор |
донор |
Донорно-акцепторная связь |
Ион аммония | |||||||||||
| F | F | F | _ | ||||||||||||||||
| │ | : | │ | │ | ||||||||||||||||
| F | ─ | B | + | : | F | : | → | F | ─ | B | : | F | → | F | ─ | B | ─ F | ||
| │ | : | │ | │ | ||||||||||||||||
| F | F | F | |||||||||||||||||
|
акцептор |
донор |
Донорно-акцепторная связь |
Тетрафторид бора | ||||||||||||||||
Совокупность химически связанных атомов (молекула, кристалл) состоит из атомных ядер и связанных с ними электронов. Положение атомных ядер экспериментально устанавливается довольно точно. Распределение электронной плотности фиксируется менее точно, поскольку в молекуле каждый из валентных электронов может быть обнаружен в окрестности любого ядра. Тем не менее каждому из этих валентных электронов, как и в атоме, соответствует определенный энергетический уровень, называемый молекулярной орбиталью (МО). При построении молекулярных орбиталей используется метод линейной комбинации атомных орбиталей (ЛКАО), обозначаемый аббревиатурой МО – ЛКАО.
Метод валентных связей (МВС), основанна предположении, что химическая связь осуществляется одной или несколькими электронными парами, локализованными между взаимодействующими атомами.
Задача 3. Что представляет собой гибридизация атомных орбиталей? В каких случаях она имеет место? Какие типы гибридизации АО вам известны? Есть ли гибридизация АО и какого типа в молекулах: N2, BCl3, PCl3?
Решение:В результате комбинации различных орбиталей (s,p,d и т.д.) возникают новые атомные орбитали промежуточной формы, которые называются гибридными. А перестройка различных орбиталей, позволяющая ей более полно перекрываться с орбиталью соседнего атома, называется гибридизацией. Гибридизация осуществляется при возбуждении атома, например:
4Be - 1s22s2
S p
| n=2 | ↑↓ |
В возбужденном состоянии:
S p
| n=2 | ↑ | ↑ |
А результате:
одна s + одна p- орбиталь → две sp- гибридные орбитали.
При гибридизации одной s- и двух p - орбиталей образуется три sp2-гибридных орбитали.
В молекуле BCl3 центральный атом В - 1s22s22p1 в возбужденном состоянии:
S p
| n=2 | ↑ | ↑ | ↑ |
Такой тип гибридизации объясняет расположение всех трех связей в молекуле BCl3 в одной плоскости.
Если со стороны атома в химических связях участвуют четыре атомные орбитали одного слоя – s-, px,py,pz, то в результате их гибридизации образуется четыре эквивалентные sp3 – орбитали.
Изменить свою «форму» атомная орбиталь может лишь комбинируясь с другими атомными орбиталями иной симметрии этого же атома. Гибридизация осуществляется при возбуждении атома, т.е. требует затрат энергии.
В молекуле атома азота:
Атом азота 7N - 1s22s22p3
S p
| n=2 | ↑↓ | ↑ | ↑ | ↑ |
Нет свободных орбиталей и возбуждения атома не происходит, поэтому в участии образовании молекулы азота не участвуют гибридные орбитали, участвуют просто три р- орбитали.
В молекуле PCl5 центральный атом Р - 1s22s22p63s2 3p3 в возбужденном состоянии:
S p d
| n=3 | ↑ | ↑ | ↑ | ↑ | ↑ |
В результате образуется пять sp3d – гибридных орбиталей.
В молекуле PCl3 центральный атом Р находится в невозбужденном состоянии:
S p d
| n=3 | ↑↓ | ↑ | ↑ | ↑ |
В связи участвуют три p-орбитали. Поэтому в молекуле PCl3 гибридизации АО не происходит.
Задача 4.Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S и линейное молекулы СО2.
Решение:Ковалентная, как и донорно-акцепторная химическая связь образуется между атомами, расположенными в пространстве друг относительно друга определенным образом – направленно. Это вызвано необходимостью наибольшего перекрывания волновых функций (атомных орбиталей) электронов, образующих связь, что должно приводить к минимальной энергии системы. По методу ВС атомная орбиталь принимает форму, позволяющую ей более полно перекрываться с орбиталью соседнего атома. Изменить свою форму атомная орбиталь может, лишь комбинируясь с другими атомными орбиталями иной симметрии этого же атома. В результате комбинации различных орбиталей (s, p, d, f и т.д.) возникают новые атомные орбитали промежуточной формы, которые называются гибридными. Получающиеся гибридные орбитали центрального атома имеют определенную направленность в пространстве. Этим и объясняется строение молекул.
16S – 1s22s22p63s23p4p-элемент
S pd
| n=3 | ↑↓ | ↑↓ | ↑ | ↑ | |||||
| n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| n=1 | ↑↓ |
Изменить свою «форму» атомная орбиталь может лишь комбинируясь с другими атомными орбиталями иной симметрии этого же атома. Гибридизация осуществляется при возбуждении атома, т.е. требует затрат энергии.
Возбуждения атома не происходит, поэтому в участии образования молекулы Н2S не участвуют гибридные орбитали, участвуют просто две р- орбитали; направление от ядра атома.
Угол между атомными орбиталями 900.
6С- 1s22s22р2
S p
| n=2 | ↑↓ | ↑ | ↑ |
В возбужденном состоянии:
S p
| n=2 | ↑ | ↑ | ↑ | ↑ |
А результате:
одна s + одна p- орбиталь → две sp- гибридные орбитали,
так как центральный атом С образует две связи с кислородом. Две sp- гибридные орбитали имеют следующее направление от ядра атома:
Угол между атомными орбиталями 1800.
Задача 5.Описать электронное строение молекул CO и CN с помощью метода валентных связей (ВС) и метода молекулярных орбиталей. Какая из молекул характеризуется большей кратностью связей.
Решение: По методу валентных связей (Дж.Льюис,1916) возникновение связи осуществляется за счет образования общей электронной пары между двумя атомами, в которую входит по одному электрону от каждого атома.
Электронные строения атомов:
6С - 1s22s22p2
7N - 1s22s22p3
8O - 1s22s22p4
Распределение электронов по квантовым ячейкам в основном и возбужденном состояниях:
6С - 1s22s22p2
S p
| n=2 | ↑↓ | ↑ | ↑ | |
| n=1 | ↑↓ |
В = 2
6С* -возбужденное состояние
S p
| n=2 | ↑ | ↑ | ↑ | ↑ |
| n=1 | ↑↓ |
В = 4
7N - 1s22s22p3
В основном состоянии:
S p
| n=2 | ↑↓ | ↑ | ↑ | ↑ |
| n=1 | ↑↓ |
На внешнем энергетическом уровне нет свободных орбиталей, поэтому для азота В=3, аналогично для кислорода:
8O - 1s22s22p4
S p
| n=2 | ↑↓ | ↑↓ | ↑ | ↑ |
| n=1 | ↑↓ |
В=2
: С : : Ö : H : C : : : N : (CN- )
С = О С ≡ N
Связи ковалентные полярные, смещены в сторону более электроотрицательных элементов (С →О; С →N)
Кратность связи равна 2 в молекуле СО и 3 в ионе СN- .
По методу молекулярных орбиталей при образовании из отдельных атомов многоатомной частицы электроны попадают в зону притяжения нескольких атомных ядер, т.е. становятся общими для всей частицы. В результате атомные орбитали трансформируются в молекулярные орбитали (МО).
Заполнение МО в молекулах и ионах и характеристики связи можно представить в виде табл. 4.
Таблица 4 - Заполнение МО в молекуле СО и ионе CN-
| Тип МО | CN- | CO |
| σх разр π yразр πzразр π yсв πzсв σх св σsразр σsсв | __ __ __ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ | __ __ __ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ |
| Кратность связи | 3 | 3 |
Многоатомные частицы, имеющие одинаковое расположение электронов в молекулярных орбиталях, называются изоэлектронными. Такие частицы имеют близкие по значению параметры связи. К таким частицам относятся N2, CN-, COи NO+.
Дата добавления: 2018-04-15; просмотров: 411; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
