Энергетика химических реакций
Химические реакции сопровождаются выделением или поглощением энергии. Если энергия выделяется или поглощается в виде теплоты, то такие реакции записываются посредством уравнений химической реакций с указанием тепловых эффектов, при этом необходимо указывать фазовый состав реагирующих веществ.
Химические реакции, протекающие с выделением тепла, называются экзотермическими, а с поглощением тепла – эндотермическими.
Изучением тепловых эффектов реакций занимается термохимия. В термохимии тепловой эффект реакции обозначается Q и выражается в кДж.
Термохимия составляет один из разделов химической термодинамики, изучающей переходы энергии из одной формы в другие и от одной совокупности тел к другим, а также возможность, направление и глубину осуществления химических и фазовых процессов в данных условиях. Каждое отдельное вещество или их совокупность представляет собой термодинамическую систему. Если термодинамическая система не обменивается с окружающей средой ни веществом, ни энергией, ее называют изолированной. Такая идеализированная система используется как физическая абстракция при рассмотрении процессов, исключающих влияние внешней среды. Система, обменивающаяся с окружающей средой только энергией, называется закрытой. Если же возможен энергетический и материальный обмен – система открытая.
Состояние системы определяется термодинамическими параметрами состояния – температурой, давлением, концентрацией, объемом и т. д. Система характеризуется, кроме того, такими свойствами как внутренняя энергия U, энтальпия H, энтропия S, энергия Гиббса G. Изизменение в ходе химических реакций характеризуют ее энергетику системы.
|
|
|
Внутренняя энергия системы U складывается из энергии движения и взаимодействия молекул, энергии связи в молекулах, энергии движения и взаимодействия электронов и ядер и т. п.
Абсолютная величина внутренней энергии не может быть определена, но ее изменение при переходе системы из начального состояния в конечное в результате осуществления химического процесса поддается расчету. Если система получает некоторое количество тепла при постоянном давлении Qp, последнее расходуется на изменение внутренней энергии системы ΔU и совершение работы A = PΔV против внешних сил:

Это уравнение выражает закон сохранения энергии или первое начало термодинамики.
Адиабатический процесс – это процесс квазистатического расширения или сжатия газа в сосуде с теплонепроницаемыми стенками. Первый закон термодинамики для адиабатического процесса принимает вид:
A = –ΔU.
Изотермический процесс – это процесс квазистатического расширения или сжатия вещества, находящегося в контакте с тепловым резервуаром, (T = const).
|
|
|
Так как внутренняя энергия идеального газа зависит только от температуры (закон Джоуля), то первый закон термодинамики для изотермического процесса записывается в виде: Q = A.
При изохорическом процессе (V = const) поглощение или выделение тепла (тепловой эффект) связано только с изменением внутренней энергии:
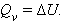
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:

ΔH = ΔU + PΔV
Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1.
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔH указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ.
|
|
|
Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное.
Например, при взаимодействии газообразных H2 и Cl2 образуются два моля газообразного HCl. Термохимическое уравнение записывается так:
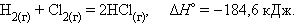
При взаимодействии газообразных H2 и O2образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии:
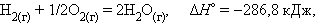
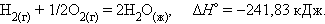
Приведенные энтальпии образования (реакций) отнесены устандартным условиям температуры и давления (T = 298 K, P = 101,325 кПа). Стандартное состояние термодинамической функции, например, энтальпии, обозначается нижним и верхним индексами:ΔΗ0298 нижний индекс обычно опускают: ΔΗ0.
Стандартная энтальпия образования ΔΗ0обр– тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.Энтальпия образования простых веществ принята равной нулю.
Пользуясь табличными значениями ΔΗ0обр, ΔΗ0сгор, можно рассчитать энтальпии различных химических процессов и фазовых превращений.
|
|
|
Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.):
«Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
Из закона Гесса вытекают следующие следствия:
1. Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
ΔH = ΣΔHобр.конечн – ΣΔHобр.нач
2. Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
ΔH = ΣΔHсгор.нач – ΣΔHсгор.конечн
3. Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образованиии продуктов реакции (–ΣEпрод).
Отсюда:
ΔH° = ΣEисх – ΣEпрод
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
4. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
ΔHобр = –ΔHразл
5. Энтальпия гидратации равна разности энтальпий растворения безводной солиΔHраств б/с и кристаллогидратаΔHраств крист.
Закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Задача 1.Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена, если продуктами сгорания являются диоксид углерода и пары воды?
Решение: С2Н2 +2,5 О2 = 2 СО2 + Н2О +Q(- ∆Η0298 )
1. По следствию из закона Гесса:
∆ Н 0р = ∑ ∆ Н 0прод - ∑∆ Н 0исход
∆ Н 0р = (2 ∆ Н 0 СО2+ ∆ Н 0 Н2О) - (∆ Н 0 С2 Н2 + 2, 5∆ Н 0 О2)=
= 2 моль*(-393,51кДж/моль) + 1 моль * (- 241,83 кДж/моль) – 1 моль *226,75 кДж/моль – 2,5 моль* 0 кДж/моль = - 1255,6 кДж/моль
∆ Н 0р = -Q; отсюда: Q = + 1255,6 кДж/моль
2. При сжигании 22,4 л С2Н2 выделяется 1255,6кДж тепла,
а при сжигании 165 л С2Н2 выделяется х кДж тепла
х = 9248,8 кДж тепла
Ответ: выделяется 9248,8 кДж тепла
Задача 2.Вычислите тепловой эффект реакции разложения карбида кальция СаС2(к) водой, в результате которой образуется гидроксид кальция Cа(OH)2 (к) и ацетилен С2Н2 (г). Сколько теплоты выделится при разложении водой 100 г карбида кальция?
Решение:СаС2(к) +2 Н2О (ж) = Cа(OH)2 (к) + С2Н2 (г)
1.По следствию из закона Гесса:
∆ Н 0р = ∑ ∆ Н 0прод - ∑∆ Н 0исход
∆ Н 0р = (∆ Н 0Cа(OH)2 + ∆ Н 0 С2Н2 ) - (∆ Н 0CаС2 + 2∆ Н 0 Н2О)=
(-986,2 + 226,75) – (- 62,7 + 2* (-285,84)) = - 125,07 кДж
2. 100 г
СаС2+ 2 Н2О = Cа(OH)2 + С2Н2 + 125,07 кДж
М= 64 г/моль
64 г СаС2- « - « - 125,07 кДж
100 г СаС2- « - « - х кДж
Х = 196,4 кДж
Ответ: 1) тепловой эффект реакции равен – 125,07 кДж; 2) при разложении 100 г карбида кальция выделяется 196,4 кДж тепла.
Задача 3. Газообразный этиловый спирт C2H5OH можно получить при взаимодействии этилена C2H4 и водяных паров H2O.
Напишите термохимическое уравнение этой реакции, предварительно вычислив тепловой эффект.
Решение:
C2H4 (г) + H2O (г) = C2H5OH (г)
По следствию из закона Гесса:
ΔH0реак = Σ ΔH0прод *ni - Σ ΔH0исх *ni
ΔH0реак = ΔH0 (C2H5OH(г)) - [ΔH0 (C2H4(г))+ ΔH0 (H2O (г) ) =
= (- 235,31 кДж/моль * 1 моль) – (52,28 – 241,83) = -235,31 -52,28 + 241,83
= - 46,06 кДж
Ответ: Термохимическое уравнение:
C2H4 (г) + H2O (г) = C2H5OH (г); ΔH0 = - 46,06 кДж
Задача 4. Определите энтальпию реакции Fe(т) + Cl2(г) = FeCl2(т), зная энтальпии следующих реакций:
Fe(т) +2 HCl(aq) = FeCl2(aq) + H2(г) ; ∆Η0 = -88,0 кДж/моль
FeCl2(т) = FeCl2(aq) ; ∆Η0 = -81,7 кДж/моль
HCl(г) =HCl(aq) ; ∆Η0 = -73,3 кДж/моль
Н2(г) + Сl2 (г) = 2 HCl(г) ; ∆Η0 = -184,4 кДж/моль
Решение: По следствию из закона Гесса:
∆ Н 0р = ∑ ∆ Н 0прод - ∑∆ Н 0исход
∆ Н 0р = ∆ Н 0(FeCl2(т)) – [∆ Н 0(Fe(т) ) + ∆ Н 0(Cl2(г) )]
Тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Т.е. термохимические уравнения можно складывать, вычитать и умножать на числовые множители.
(1) Fe(т) +2 HCl(aq) = FeCl2(aq) + H2(г); ∆Η0 = -88,0 кДж/моль
(2) FeCl2(т) = FeCl2(aq) ; ∆Η0 = -81,7 кДж/моль
(3) HCl(г) = HCl(aq); ∆Η0 = -73,3 кДж/моль
(4) Н2(г) + Сl2 (г) = 2 HCl(г) ; ∆Η0 = -184,4 кДж/моль
Отсюда:
∆ Н 0р = (1)– (2) + 2* (3) + (4) = -88,0 – (-81,7) + 2*(-73,3) + (-184,4) =
= - 264,0 кДж
Ответ: энтальпия реакции Fe(т) + Cl2(г) = FeCl2(т) равна - 264,0 кДж.
Изменение энтальпии системы не может служить единственным критерием самопроизвольного осуществления химической реакции, поскольку многие эндотермические процессы протекают самопроизвольно.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
Л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Поскольку число частиц в системе велико (число Авогадро NA = 6,02∙1023), то энтропия пропорциональна натуральному логарифму термодинамической вероятности состояния системы W:
S = R · ln W
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии в необратимых и обратимых процессах передается соотношениями:
ΔS > Q / T и ΔS = Q / T
Например, изменение энтропии плавления равно теплоте (энтальпии) плавления: ΔSпл = ΔHпл/Tпл
Для химической реакции изменение энтропии аналогично изменению энтальпии:
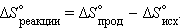
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным TΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж):
ΔG = ΔH – TΔS
При ΔG < 0 реакция термодинамически разрешена и система стремится к достижению условия ΔG = 0, при котором наступает равновесное состояние обратимого процесса; ΔG > 0 указывает на то, что процесс термодинамически запрещен.
Задача5. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G0298 реакции, протекающей по уравнению:
СО2(г) + 4 Н2(г) = СН4(г) + 2 Н2О(ж)
Возможна ли эта реакция при стандартных условиях?
Решение:1. По следствию из закона Гесса:
∆ Н 0р = ∑ ∆ Н 0прод - ∑∆ Н 0исход
∆ Н 0р = (∆ Н 0 СН4+ 2 ∆ Н 0 Н2O) - (∆ Н 0 СO2 + 4 ∆ Н 0 Н2) =
= (-74,85) + 2*(-285,84) – (-393,51) – 4*0 = - 253,02 кДж
2. 2. ∆ S0р = ∑ S0прод - ∑ S0исход
∆ S0р = (186,19 + 2*69,94) - (213,65 +4* 130,59) = 326,07 - 736,01 =
= - 409,94 Дж/ К
2. ∆G298 = ∆ Н 0298 - Т *∆ S 0298 = -253,02 – 298*(-409, 94/1000) =
= -253,02 + 122,16 = - 130,86 кДж
Ответ: ∆Gреакц < 0 , следовательно, при стандартных условиях реакция протекать будет.
Задача 6. Вычислите ΔG0298 для следующих реакций:
а) 2 NaF(к) + Cl2 (г) = 2 NaCl (к) + F2 (г)
б) PbO2 (к) + 2Zn(к) = Pb (к) + 2ZnО (к)
Решение: Если ΔG0< 0, то процесс принципиально осуществим.ΔG0 для простых веществ равно 0.
а) ΔG0298 = 2 ΔG0298 (NaCl (к)) - 2 ΔG0298 (NaF (к)) = 2*(-284,03) – 2(-541,0) = +313,94 кДж
б) ΔG0298 = 2 ΔG0298 (ZnО(к)) - 2 ΔG0298(PbO2(к)) = 2*(-318,2) – 2(-219,0) = - 417,4 кДж
Следовательно, реакция:
а) не возможна;
б) возможна.
Задача 7.Реакция протекает по уравнению:
ZnO (к) + CO (г) = Zn (к) + CO2 (г)
Вычислите ∆G этой реакции, используя табличные значения ∆ Н 0298 и ∆ S 0298 и сделайте вывод о возможности самопроизвольного протекания реакции.
Решение:1. По следствию из закона Гесса:
∆ Н 0р = ∑ ∆ Н 0прод - ∑∆ Н 0исход
∆ Н 0р = (∆ Н 0Zn+ ∆ Н 0CO2 ) - (∆ Н 0ZnO+ ∆ Н 0CO) =
( 0 + (- 393,51)) – (- 349,0 + (-110,5)) = + 65,99 кДж
2. ∆ S0р = ∑ S0прод - ∑ S0исход
∆ S0р = (41,59 + 213,6) - (43,5 + 197,4) = 14,29 Дж/ К
3. ∆G298 = ∆ Н 0298 - Т *∆ S 0298 = 65,99 – 298*14,29/1000 = + 61,73 кДж
Ответ: ∆Gреакц > 0 , следовательно, при стандартных условиях реакция протекать не будет.
Дата добавления: 2018-04-15; просмотров: 354; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
