Приложение Д Стандартные окислительно-восстановительные потенциалы
⇐ ПредыдущаяСтр 8 из 8
| Окислительная форма | +e– | Восстановительная форма | E°, В |
| Li+ | 1e– | Li | –3,02 |
| Na+ | 1e– | Na | –2,71 |
| Mn2+ | 2e– | Mn | –1,05 |
| Zn2+ | 2e– | Zn | –0,76 |
| Cr3+ | 3e– | Cr | –0,74 |
| Fe2+ | 2e– | Fe | –0,44 |
| Cd2+ | 2e– | Cd | –0,40 |
| Ti3+ | 1e– | Ti2+ | –0,37 |
| Co2+ | 2e– | Co | –0,29 |
| Ni2+ | 2e– | Ni | –0,23 |
| Sn2+ | 2e– | Sn | –0,14 |
| Pb2+ | 2e– | Pb | –0,13 |
| 2H+ | 2e– | H2 | 0,00 |
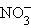 + H2O + H2O
| 2e– | 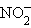 + 2OH– + 2OH–
| +0,01 |
| Ti4+ | 1e– | Ti3+ | +0,04 |
| Sn4+ | 2e– | Sn2+ | +0,15 |
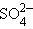 + 2H+ + 2H+
| 2e– | 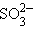 + 2H2O + 2H2O
| +0,17 |
| Cu2+ | 2e– | Cu | +0,34 |
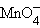
| 1e– | 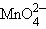
| +0,56 |
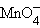 + 2H2O + 2H2O
| 3e– | MnO2 + 4OH– | +0,60 |
| Fe3+ | 1e– | Fe2+ | +0,77 |
| Ag | 1e– | Ag+ | +0,80 |
| Br2 | 2e– | 2Br– | +1,07 |
| O2 + 4H+ | 4e– | 2H2O | +1,23 |
| Cl2 | 2e– | 2Cl– | +1,36 |
Cr2 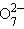 + 14H+ + 14H+
| 6e– | 2Cr3+ + 7H2O | +1,37 |
| PbO2 + 4H+ | 2e– | Pb2+ + 2H2O | +1,46 |
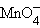 + 8H+ + 8H+
| 5e– | Mn2+ + 4H2O | +1,51 |
| H2O2 + 2H+ | 2e– | 2H2O | +1,77 |
| F2 | 2e– | 2F– | +2,87 |
Приложение Ж Названия углеводородов и радикалов
| Углеводород | Формула | Радикал | Формула |
| Метан | СН4 | Метил | СН3 – |
| Этан | СН3 – СН3 | Этил | СН3 – СН2 – |
| Пропан | СН3 – СН2 – СН3 | Пропил | СН3 – СН2 – СН2 – |
| Бутан | СН3 – (СН2 )2 –СН3 | Бутил | СН3 – (СН2 )2 – СН2 – |
| Пентан | СН3 –(СН2 )3 – СН3 | Пентил | СН3 –(СН2 )3 – СН2 – |
| Гексан | СН3 – (СН2 )4 – СН3 | Гексил | СН3 – (СН2 )4 – СН2 – |
| Гептан | СН3 – (СН2 )5 – СН3 | Гептил | СН3 – (СН2 )5 – СН2 – |
| Октан | СН3 – (СН2 )6 – СН3 | Октил | СН3 – (СН2 )6 – СН2 – |
| Нонан | СН3 – (СН2 )7 – СН3 | Нонил | СН3 – (СН2 )7 – СН2 – |
| Декан | СН3 – (СН2 )8 – СН3 | Декил | СН3 – (СН2 )8 – СН2 – |
| Изопропил | СН3 – СН – СН3 | | ||
| Изобутан | СН3 – СН – СН3 | СН3 | Изобутил (трет-бутил) | | СН3 – С – СН3 | СН3 |
| Этен | СН2 = СН2 | Винил | СН2 = СН – |
Дата добавления: 2018-04-15; просмотров: 392; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
