Выявление посторонней и вредной микрофлоры
«Дикие» дрожжи. Ганзен разделил все дрожжи на культурные и «дикие». «Дикими» называются виды дрожжей, попадающие случайно и нехарактерные для данного производства. В хлебопечении это микроорганизмы р. Сandida, Torulopsis, Pichia.
Обнаружение диких дрожжей основано на их способности усваивать лизин в качестве единственного источника азота. Пробы прессованных дрожжей, муки, закваски или теста высевают на агаризованную синтетическую среду с лизином, предложенную Лакруа. На ней особенно хорошо растут виды р. Candida, которые наиболее часто встречаются в хлебопекарном производстве. Наиболее часто в полуфабрикатах хлебопекарного производства встречаются дрожжи вида C. krusei, C. mycoderma, C. utilis.
Для вида C. krusei характерны клетки разнообразной формы и разных размеров, часто похожие на клетки сахаромицетов. Колонии дрожжи на сусло-агаре образуют плоские, матовые белого или кремового цвета с извилистым краем, а также хорошо развитый псевдомицелий. Из сахаров активно сбраживают только глюкозу. Резко понижают мальтазную активность прессованных дрожжей.
Клетки дрожжей вида C.mycoderma имеют овальные или удлиненные форму, образуют плоские матовые колонии белого или сероватого цвета с ровными или мелко зазубренными краями. Дрожжи не сбраживают сахара и ухудшает подъемную силу прессованных дрожжей.
Для дрожжей С.utilis характерны небольшие клетки овальной или удлиненной формы. На сусло-агаре дрожжи образуют колонии сероватого цвета с блестящей гладкой поверхностью и волнистым краем. Дрожжи сбраживают глюкозу, сахарозу, частично рафинозу, ухудшают подъемную силу прессованных дрожжей.
|
|
|
Сахаромицеты не способны использовать лизин и не растут на среде Лакруа или образуют еле различимые, точечные колонии.
Дрожжи несахаромицеты негативно влияют на процесс брожения теста – они, обладая более высокой скоростью роста, конкурируют с сахаромицетами за водорастворимые сахара муки и вытесняют их. Поскольку для «диких» дрожжей характерен окислительный метаболизм, то углекислый газ они практически не производят. В целом это негативно отражается на подъемной силе полуфабрикатов – она уменьшается; выпеченный хлеб имеет меньший объем, мякиш хлеба –плотный и низкопористый.
Основными источниками обсеменения пшеничных полуфабрикатов дикими дрожжами служат прессованные дрожжи. Анализ образцов товарных дрожжей показал, что количество посторонних дрожжей в различных партиях колеблется от 15 до 45 %.
Выявление термофильной палочки Bacillus сoagulans (Lactobacillus thermophilum).К технически вредным микроорганизмам относятся и некоторые термофильные палочковидные бактерии, например Bac. coagulans (Lac.thermophilum). Клетки у этих аспорогенных термофильных бактерий одиночные размером (4-10)´(0,7-0,9) мкм. Глубинные колонии образуют темные и мелкие, поверхностные – более крупные и локонообразные или зернистые с темным центром.
|
|
|
Эти бактерии могут вызывать интенсивное кислотонакопление, а также образование тягучих сгустков, ослизнение молочной сыворотки и закваски. Отличительным признаком Bac. coagulans (Lac. thermohhilum) является наличие зерен волютина в клетках бактерий. Для выявления термофильной палочки хорошие результаты получаются при использовании агара с гидролизованным молоком.
Лейконосток (Leuconostoc mesenteroides) относится к стрептоккокам. На средах, богатых сахаром, лейконосток образует слизистую капсулу, состоящую из декстрина. Как и Bac. coagulans, лейконосток может вызывать образование слизистых сгустков в жидких заквасках с заваркой.
Лейконосток хорошо выявляется на дрожжевом агаре с сахарозой или на среде 10, приготовленной на основе дрожжевой воды. На плотных средах лейконосток образует характерные прозрачные каплевидные колонии.
Эти микроорганизмы, попадая в закваски, вытесняют нормальную микрофлору, вызывая порчу заквасок. Они могут вызывать интенсивное кислотонакопление, а также образование тягучих сгустков, что приводит к ухудшению качества заквасок. Результатом их действия могут являться такие дефекты, как пустоты мякиша и непромесы.
|
|
|
Выявление гнилостных бактерий.Гнилостные бактерии активно разлагают белки. Они являются антагонистами по отношению к молочнокислым бактериям и дрожжам сахаромицетам. В закваски и тесто гнилостные бактерии попадают с сырьем (прессованные дрожжи, молочные продукты и яйцепродукты).
Для учета гнилостных бактерий применяют молочный агар Богданова. На этой среде бактерии образуют в основном белые или желтоватые колонии с прозрачной зоной растворения белков молока вокруг колоний.
Источником инфекции могут быть трубопроводы и сложные коммуникации, особенно участки и узлы, трудно доступные для очистки и мойки.
Гнилостные бактерии опасны тем, что способны образовывать токсины, вызывающие отравления. С молочным сырьем они могут попадать в кремовый полуфабрикат кондитерских изделий. Для предотвращения их развития в кремовые полуфабрикаты добавляют консерванты: сорбиновую кислоту (СН3-СН=СН-СН=СН-СООН) и ее водорастворимые соли.
Чудесная палочка. Chromobacterium prodigiosum (Serratia marcescens) представляет собой подвижные, перетрихальные палочки, образующие пигмент, размером (0,6-1,0)´0,5 мкм, одиночные или в коротких цепочках по 3-6 клеток. Она является факультативным анаэробом, спор не образует. Колонии на МПА – гладкие или зернистые, окрашенные в темно- или ярко-красный цвет с металлическим блеском. Оптимальная температура роста 25-30 оС. При температуре 40 оС она погибает. Она встречается в воде, воздухе, почве или на продуктах питания. Хлеб с покрасневшим мякишем теряет вид и непригоден к употреблению.
|
|
|
Выявление споровых бактерий.Наиболее распространенным заболеванием хлеба является картофельная болезнь, которая поражает мякиш пшеничного хлеба главным образом в весенне-летний период года. Пораженный хлеб сначала теряет свой естественный вкус и аромат, затем появляется своеобразный сладковатый запах. Мякиш становится липким, при разломе наблюдаются слизистые, тянущиеся нити. Цвет мякиша изменяется: образуются коричневатые или желто-бурые, розовато-грязные пятна. При сильном развитии болезни хлеб превращается в темную слоистую массу с резким специфическим запахом и неприятным вкусом.
Хлеб с признаками картофельной болезни может вызвать нарушение функций желудочно-кишечного тракта, поэтому он подлежит уничтожению.
Микробиологическая природа картофельной или тягучей болезни хлеба была впервые установлена в 1885 г. Г. Лораном, который выделил из слизи хлеба споровую «картофельную» палочку Bacillus mesentericus (картофельная палочка). Позднее выяснилось, что Bac. subtilis (сенная палочка) также вызывает картофельную болезнь хлеба. В настоящее время, бациллы вызывающие порчу хлеба квалифицируют как подвид Bacillus subtilis ssp. mesentericus.
Для выявления споровых бактерий используют мясопептонный агар, молочный агар, сусло-агар. Перед посевом пробы прогревают при 90-95 оС в течение 10 мин, чтобы убить все вегетативные клетки микробов.
По морфологическим признакам эти культуры мало отличаются друг от друга. Это мелкие, подвижные (в молодых культурах) палочки со слегка занутыми концами, расположенные одиночно или цепочками. В жидких средах они могут образовывать длинные нити. По размерам клеток Bac. mesentericus несколько превосходит Bac. subtilis (1,5-5)´(0,65-0,7 мкм). Оба вида образуют споры, причем у Baс. mesentericus размеры спор совпадают с размером поперечника клетки, а у Bac. subtilis поперечник споры всегда немного больше ширины клетки.
Споры картофельной и сенной палочек хорошо переносят кипячение и высушивание. Губительной температурой для них является лишь 121 оС, что достигается путем стерилизации в автоклаве при давлении 0,1 мПа.
По характеру роста на агаризованных средах оба вида различаются между собой. Для Bac. subtilis характерным диагностическим признаком является образование ветвистых выростов. На МПА она образует ветвящиеся колонии или колонии в виде цветка. Колонии врастают в агар, а на поверхности образуются капли слизи. На сусло-агаре колонии более слизистые, иногда бесформенные.
Колонии Bac. mesentericus более разнообразны по форме и виду. Чаще встречаются слизисто-складчатые с кожистой пленкой на поверхности или морщинистые, более сухие колонии. Не врастают в агар.
Все культуры картофельной палочки энергично разжижают желатин, восстанавливают нитраты до нитритов, имеют высокую каталазную активность, активно гидролизуют крахмал, не сбраживают галактозу, пентозы и, за редким исключением, сахарозу и мальтозу. Оптимальная температура роста 37-40 оС, но хорошо размножаются и при более низких значениях температуры (30 оС), рН от 5 до 10.
Вегетативные клетки Bac. subtilis погибают при температуре 75-80 °С. Споры картофельной и сенной палочек хорошо переносят кипячение и хорошо выдерживают температуру выпечки хлеба, как и высушивание. Губительной температурой для них является лишь 121 оС, что достигается путем стерилизации в автоклаве при давлении 0,1 мПа.
Споровые бактерии попадают в муку при размоле зерна, которое заражается главным образом в процессе уборки. В отдельных случаях источником зараженности споровыми бактериями могут быть прессованные дрожжи, отруби, соевая мука и др. На зараженность бактериями и появление картофельной болезни хлеба оказывают влияние нарушения санитарного и технологического режима хранения и переработки зерна, производства муки и хлеба.
В связи с повышением загрязненности окружающей среды (воды, воздуха, почвы), нерациональным применением химических удобрений, недостаточной обработкой зерна перед помолом, поражение хлеба картофельной болезнью значительно возросло. Если ранее данное заболевание наблюдалось в районах Средней Азии, Молдавии, юге Украины в основном в летнее время (с мая по октябрь), то сейчас распространение картофельной болезни переместилось в северные области Европейской части России, районы Урала, Западной и Восточной Сибири. Кроме того, период и продолжительность заболевания хлеба сместились на осенние, весенние и даже зимние месяцы.
Для предупреждения картофельной болезни хлеба необходимым является осуществление контроля сырья и готовой продукции с целью выявления их микробиологической загрязненности.
При наличии спор в 1 г муки до 200 КОЕ/г муку считают нормальной, менее 103 КОЕ/г - сомнительной, 103 КОЕ/г и более - загрязненной, вызывающей картофельную болезнь хлеба.
Для выработки микробиологически чистой продукции на хлебозаводах используется система мероприятий по предотвращению картофельной болезни хлеба.
Основным мероприятием является повышение кислотности полуфабрикатов, ингибирующей ферментативную активность споровых бактерий. С этой целью применяются различные подкисляющие средства: химические и биологические.
К химическим средствам относятся: молочная, уксусная, пропионовая кислоты и их соли (кальций уксуснокислый, пропионаты натрия, калия, кальция, диацетат натрия и др.), которые используют в виде растворов при замесе теста, либо в составе комплексных хлебопекарных улучшителей.
Для подкисления теста применяются также различные полуфабрикаты предыдущего приготовления (опара, тесто).
Наиболее эффективными и практически реализуемыми являются биологические способы подавления картофельной болезни путем применения различных заквасок, к которым относятся:
- мезофильная высококислотная пшеничная закваска (22-25 град), приготовленная на чистых культурах молочнокислых бактерий Lac. fermenti;
- концентрированная молочнокислая закваска (КМКЗ) на чистых культурах Lac. plantarum, Lac. brevis, Lac. fermenti, Lac. casei и др.;
- жидкие дрожжи, приготовленные по рациональной схеме с улучшенными биотехнологическими свойствами. В регионах с жарким климатом в технологии жидких дрожжей используются штаммы чистых культур термофильных молочнокислых бактерий и дрожжей, которые отличаются термостойкостью и кислотоустойчивостью;
- пропионовокислая закваска на чистой культуре Propionibacterium freundenreichii ssp. shermanii BKM-103 – комплексная закваска на чистых культурах пропионовых и молочнокислых бактерий.
Наибольшее антибактериальное действие оказывает пропионовокислая закваска. Сравнительные испытания показали, что пробы хлеба на жидких дрожжах и КМКЗ заболевали через 36 ч, мезофильная закваска замедляла процесс заболевания хлеба до 48 ч, при использовании пропионовокислой закваски хлеб не заболевал в течение 72 ч.
Средством подавления развития картофельной болезни в хлебе являются также антибиотические вещества. В последние годы на хлебозаводах используются препараты («Селектин») на основе бактериоцинов, выделенных при культивировании молочнокислых стрептококков. Эти антибиотики воздействуют непосредственно на споры картофельной палочки, снижают их термоустойчивость, нарушают проницаемость цитоплазматической мембраны и ингибируют размножение клеток.
Наличие картофельной болезни в хлебе в основном зависит от микробиологического состояния муки. Показатель зараженности муки споровыми бактериями, определяемый технологическим методом, включен в СанПиН 2.3.2.1078-01.446.
Для предотвращения картофельной болезни целесообразно использовать консервирующие агенты при замесе теста из муки сомнительного качества. Обычно заведомо зараженную муку спорами бактерий подмешивают к непораженной муке. Из сомнительной муки для предотвращения картофельной болезни вырабатывают изделия низкой влажности (сухари, сушки, баранки, хлебные палочки), высококислотные сорта хлеба и мелкоштучные сдобные изделия с малым сроком хранения.
Дрожжеподобные грибы, вызывающие меловую болезнь. В порче хлеба принимают участие два вида дрожжеподобных грибов – Endomycopsis fibuliger и Endomycopsis chodacii. При их развитии на поверхности корки и в мякише образуются белые, сухие, порошкообразные пятна, похожие на мел. Этот порок хлеба получил название меловая болезнь.
Крайне редко встречаются на хлебе пятна красной слизи, вызванные дрожжеподобными грибами р. Rhodotorula, или оранжевые, желтые и синие пятна от развития Ascosporium roseum, Oidium aurantiacum.
Плесневые грибы. Плесневение является самым распространенным видом микробиологической порчи пищевых продуктов, в том числе хлебобулочных изделий.
Установлено, что на поверхности остывшего хлеба оседает от 100 тыс. до 100 млрд. спор микроорганизмов в минуту, которые при благоприятных условиях прорастают с образованием макроколоний.
Источником плесневения хлеба является развитие плесневых грибов рода Aspergillus (A. flavus, A. fumigatus, A. niger, A. ochraceus), Mucor (M. mucedo, M. pusius, M. spinosus), Penicillium (P. crustosum, P. expansum), Rhizopus nigricans, Geotrichum candidum, которые образуют на поверхности изделий пушистые налеты серого, зеленого, белого, голубоватого, черного и желтого цвета. Размножаются плесени спорами. Споры собраны в спорангии или расположены на конидиеносцах (рис.4.1). При созревании одного спорангия образуются сразу сотни спор. Каждая дает начало новому мицелию.
Род Мисог.Плесневые грибы р. Mucor относятся к низшим грибам, к классу Phycomycetes. Мицелий у них обильно ветвящийся, но несептированный. Кверху от него отходят гифы-спорангиеносцы, несущие шарообразные спорангии, видимые простым глазом в виде головок, внутри которых находятся споры. Стенки спорангиев растрескиваются, освобождая споры, которые, попав в благоприятные условия, вновь прорастают в мицелий. Обычно у мукоровых грибов мицелий бывает вначале белый, позднее сероватый. Спорангии вначале желтоватые, позже темнеют, приобретая черную окраску.
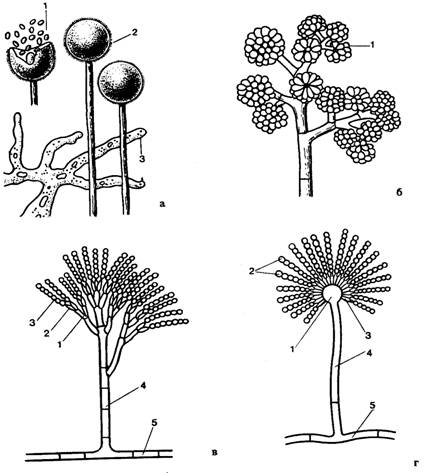
Рис.4.1. Споры бесполого способа размножения:
а - Mucor: 1 – споры; 2 – спорангий; 3 – мицелий; б – Botrytis: 1 – конидии; в – Penicillium: 1 – метулы; 2 – стеригмы; 3 – конидии; 4 – конидиофор; 5 – вегетативная гифа; г – Aspergillius: 1 – булововидное расширение конидиеносца; 2 – конидии; 3 – стеригмы; 4 - конидиофор; 5 – вегетативная гифа
Бесполое размножение мукоровых грибов может происходить также оидиями - дрожжеподобными образованиями, называемыми мукоровыми дрожжами.
Они образуются путем распада гифов на отдельные короткие членики при попадании мицелия в жидкую питательную среду с недостаточным притоком воздуха. Мукоровые дрожжи обладают слабой сбраживающей способностью. При свободном доступе воздуха к среде они снова прорастают в мицелий.
Род Aspergillus.Грибы р. Aspergillus относятся к высшим грибам, так как имеют многоклеточный мицелий. Конидиеносцы плесневых грибов этого рода несептированы, на верхнем конце их находятся шаровидные или булавовидные вздутия. От вздутий отходят во все стороны по одному или по два ряда стеригм и цепочки конидий.
Общая картина конидиеносца с конидиями напоминает головку лейки, из которой струями выходят водяные брызги. Это сходство и привело к названию леечная плесень (по-латински аспергере - поливать, опрыскивать).
В зависимости от видовой принадлежности аспергиллов конидии их бывают окрашены в зеленый, желтовато-зеленый, бурый, темно-коричневый или черный цвет. Благодаря огромному их количеству, расположенному на приземистых конидиеносцах, весь налет плесени кажется окрашенным в цвет конидий.
Аспергиллы относятся к классу Ascomycetes. Половое размножение у них происходит спорами, образующимися в округлых сумках (асках), расположенных в замкнутых плодовых телах (клейстокарпиях), диаметром от 80-350 мкм.
Род Penicillium.Грибы р. Penicillium относятся к высшим грибам к классу Ascomycetes и являются наиболее распространенными среди плесневых грибов.
У пенициллов конидиеносцы большей частью имеют поперечные перегородки. В верхней части конидиеносцы разветвлены и образуют характерно построенную кисточку (отсюда и название пенициллиум, по-латински - кисть), несущую на конечных разветвлениях цепочки конидий. Различное строение кисточки у разных видов пенициллов положено в основу их систематики. Конидиеносцы часто прилегают плотно один к другому или склеены в коремии (от греч. корос - веник). Конидии у большинства видов пенициллов зеленого цвета, характерной для видов формы. Сверху они покрыты слоем воска, вследствие чего трудно смачиваются водой. Конидии могут размножаться даже после многолетнего пребывания в сухом состоянии. Они быстро прорастают в кислых средах. В нейтральных или щелочных средах прорастание их замедляется или не происходит.
Споры полового размножения образуются в асках (сумках), расположенных в плодовых телах (клейстокарпиях). Клейстокарпии обнаружены не у всех видов пенициллов, но по типичному строению конидиеносцев их относят к одному роду.
Для размножения плесеней оптимальными условиями являются температура 25-35 оС и относительная влажность воздуха 70-80 %. Отмечается возможность развития плесневых грибов при низкой влажности продукта (15 %). Плесени относятся к строгим аэробам, развиваются только при доступе воздуха. Споры устойчивы к внешним воздействиям. Они могут долгое время (до 15 лет) сохранять свою жизнедеятельность.
Как правило, видимый рост колоний грибов на пшеничном хлебе наблюдается на 4-5 сут., на ржаном и ржано-пшеничном – на 6-8 сут.
Все плесневые грибы неблагоприятно влияют на качество сырья и готового хлеба. Плесневение мякиша обычно начинается смест, примыкающих к трещинам или подрывам в корке или к участкам с наиболее тонкой и недостаточно обезвоженной корочкой.
Расщепляя при помощи своих ферментов белки, углеводы и жиры, они вызывают глубокие изменения в хлебе. Продукты метаболизма плесневых грибов придают продуктам неприятный затхлый запах. Кроме того, они могут выделять токсины.
Известно около 80 видов плесневых грибов, которые образуют микотоксины. Из них около 20 видов Aspergillus и пяти видов Penicillium. Среди ядов, вырабатываемых плесенями, известны шесть типов афлатоксинов (В1, В2, М1, М2, G1, G2), патулин, охратоксины и рубратоксины. В хлебе, пораженном A. flavus, обнаружены афлатоксины G1 и В1 которые концентрировались в основном в наружных слоях хлеба, но проникали и в мякиш.
Особую опасность представляет развитие грибов из р. Fusarium. Обычно они поражают зерно, перезимовавшее в поле, а также зерно, собранное в неблагоприятных условиях уборки урожая. Образуемые ими токсины (дезоксиниваленол, зеараленон и др.) не разрушаются в процессе выпечки хлеба. При этом зараженный хлеб не имеет внешних признаков болезни, но употребление его в пищу вызывает острое отравление, симптомы которого напоминают опьянение (головокружение, тошнота). Поэтому данный порок хлеба получил название «пьяный» хлеб.
В отличие от бактерий-вредителей плесневые грибы могут являться вторичной инфекцией, которая поражает уже готовую продукцию, вследствие обсемененности промышленных помещений и оборудования.
Количество плесневых грибов на поверхности изделий в значительной степени зависит от обсемененности плесенями воздуха производственных помещений (коэффициент корреляции 0,85). Корреляции между обсемененностью воздуха и стен, воздуха и пола прямые и значимые (коэффициенты корреляции 0,88 и 0,86).
Поэтому мероприятия по предотвращению плесневения хлеба в первую очередь предусматривают снижение зараженности спорами плесеней воздуха производственных помещений и хлебохранилища, а также оборудования и инвентаря, на котором хранится и транспортируется готовая продукция. Для этого необходимо соблюдение санитарно-гигиенического состояния производственных помещений, борьба с запылением воздуха и хорошая вентиляция, особенно в хлебохранилище. Оборудование и инвентарь, используемые при хранении и транспортировании готовой продукции, должны содержаться в очищенном состоянии, промываться и дезинфицироваться.
Исследования показали высокую эффективность дезинфицирующих средств на основе четвертичных аммонийных солей (ЧАС), применение которых при проведении регулярной санитарной обработки поверхностей производственных помещений снижает обсемененность их плесневыми грибами в 10-30 раз по сравнению с хлорной известью и далее поддерживает на низком уровне.
Установлена эффективность покрытия поверхностей помещения лакокрасочными материалами (широко используется на хлебозаводах Англии, Франции и др. стран), снижающего содержание плесневых грибов в воздухе на 99,5 %
Упаковка хлебобулочных изделий продлевает сроки микробиологической устойчивости их при хранении.
Установлена прямая зависимость между плесневением изделий и обсемененностью муки спорами бактерий. Так, при количестве спор Bac. subtilis в пшеничной муке 100 КОЕ/г изделия плесневели на 5-6 сут. хранения, 500 КОЕ/г – на 4-5 сут., а при 1000 КОЕ/г – на 3-4 сут. Чем больше обсемененность муки спорами бактерий, тем быстрее развиваются плесневые грибы на поверхности хлеба. Поэтому использование консервантов (пропионовой, сорбиновой, лимонной, янтарной, муравьиной, фумаровой и молочной кислот, а также их кальциевых и натриевых солей) может опосредованно, сдерживая рост бацилл, способствовать продлению срока хранения хлебобулочных изделий.
Экспериментально установлено повышение активности воды в период хранения хлеба из муки с большой обсемененностью спорами бактерий. Это, вероятно, связано с тем, что экзоферменты бактерий в процессе их жизнедеятельности разрушают микроструктуру мякиша, увеличивая, таким образом, количество свободной воды, мигрирующей из мякиша к корке и, соответственно, интенсивность роста плесневых грибов.
Изучены фунгицидные свойства натриевой соли дегидроацетовой кислоты (Na-ДГА). При добавлении в тесто Na-ДГА в количестве 0,12% к массе муки срок предотвращения плесневения булочных изделий из муки пшеничной высшего сорта увеличивается с 4 до 7 сут. При обработке поверхности изделий растворами Na-ДГА срок хранения их увеличивается до 7-10 сут.
Развитие плесеней замедляется при хранении полуфабрикатов и готовой продукции в замороженном состоянии (-24 оС), в вакууме или атмосфере азота или углекислого газа.
Физические ингибиторыплесневения хлеба включают различные способы физических воздействий на поверхность хлеба с целью его стерилизации: ионизирующее облучение, токи СВЧ, озонирование и др.
На предприятиях Германии функционируют крупные промышленные установки, в которых нарезанный и упакованный хлеб подвергается микроволновой стерилизации, в том числе и в непрерывном режиме.
Известны также способы пастеризации или стерилизации пищевых продуктов, сочетающие нагрев с помещением в модифицированную атмосферу. Хлеб помещают в камеру, в которой создают вакуум, и затем подают нагретый до температуры 150-300 °С газ (например, углекислый газ). При этом продукт нагревается до 75-100 °С.
Для предотвращения плесневения хлеба используется также комбинированная обработка поверхности хлеба – озонирование с последующей упаковкой. При этом способе воздействия срок хранения хлеба повышается на 3 сут.
Микробиологическая порча хлеба наносит серьезный ущерб народному хозяйству. Разнообразие методов и приемов, предложенных для борьбы с основными возбудителями болезни хлеба, указывает на отсутствие единого радикального средства. Чтобы предупредить развитие болезней хлеба, необходимо применять целый комплекс мероприятий. Правильно организованный микробиологический контроль хлебопекарного производства играет в этом большую роль.
Контрольные вопросы
1. На какие группы подразделяют вредителей хлебопекарных производств?
2. Каким образом выявляют постороннюю микрофлору?
3. Перечислите микроорганизмы, вызывающие порчу хлебобулочных изделий.
4. Охарактеризуйте ухудшителей хлебопекарного производства. Почему в их присутствии понижается подъемная сила?
5. По каким показателям судят о присутствии гнилостной микрофлоры? Чем опасна гнилостная микрофлора?
6. Почему нежелательно присутствие споровых палочек Bacillus mesentericus и Bacillus subtilis в готовых изделиях?
7. Каковы способы борьбы с картофельной болезнью хлеба?
8. Какой хлеб чаще поражается картофельной болезнью?
9. Охарактеризуйте плесневые грибы, как вредителей хлебопекарных производств. Каких представителей плесневых грибов вы знаете?
10. Каких вредителей хлебопекарных производств вы знаете среди дрожжеподобных грибов?
МИКРООРГАНИЗМЫ – ВРЕДИТЕЛИ
БРОДИЛЬНЫХ ПРОИЗВОДСТВ
Условия производства вин далеки от стерильных. На оборудовании, в стеклянных трубопроводах, в емкостях для сбраживания сусла и хранения вина всегда есть живые микроорганизмы, которые при переработке винограда попадают в сусло и вино.
При определении обсемененности микроорганизмами вымытых и стоящих пустыми железобетонных емкостей, не облицованных изнутри стеклянной плиткой, а покрытых слоем винного камня обнаружено, что основной микрофлорой в них были плесневые грибы родов Penicillium и Aspergillus и дрожжи, причем преобладали пленчатые дрожжи родов Pichia и Candida. При посевах на питательные среды смывов с поверхностей емкостей установлено, что в 85 % проб содержались живые плесневые грибы и в 81 % проб - живые дрожжи. Уксуснокислые и молочнокислые бактерии были обнаружены в количестве 44 и 33 % соответственно.
По данным В. П. Журавлевой, в микрофлоре оборудования и тары винодельческих заводов преобладают дрожжи-сахаромицеты, реже встречаются пленчатые дрожжи родов Pichia, Hansenula, Candida, а также плесневые грибы и бактерии.
Ж. Риберо-Гайон и Э. Пейно приводят результаты идентификации 132 штаммов дрожжей, выделенных в винподвалах с оборудования, тары, инвентаря, и показывают, что они распределяются следующим образом.
Оборудование и емкости винодельческих заводов являются источниками дрожжей, плесневых грибов, уксуснокислых и молочнокислых бактерий, попадающих в виноградное сусло и вино. Количество микроорганизмов зависит от санитарного состояния оборудования и емкостей. На винодельческих заводах необходимо строго следить за тем, чтобы сразу после освобождения от сусла или вина емкости и оборудование тщательно промывались водой и их поверхности не служили питательным субстратом для размножения различных групп микроорганизмов.
В винах, поступающих на розлив в бутылки, тоже содержатся микроорганизмы. При розливе вина в бутылки на обычных нестерильных линиях обнаружено от 10 до 500 живых дрожжевых клеток в 1 мл вина. Аналогичные данные приведены у Э. Пейно и С. Сапи-Домерк о содержании живых микроорганизмов в винах, разливаемых в бутылки в районе Бордо.
Дрожжи являются основной причиной биологических помутнений столовых вин, разлитых в бутылки. Определение систематического положения дрожжей, выделенных из помутневших столовых вин, позволило обнаружить в них дрожжи родов Saccharomyces, Brettanomyces, Pichia, Hansenula и Candida. Среди сахаромицетов наиболее часто выделяются из помутневших вин дрожжи вида Sacch. oviformis как наиболее спиртовыносливые и приспособленные к жизнедеятельности в винах.
Достаточно бывает присутствия нескольких живых дрожжевых клеток в 1 мл вина, разливаемого в бутылки с доступом воздуха, чтобы в нем спустя некоторое время возникло дрожжевое помутнение. Применяемые дозы сернистой кислоты для стерилизации готовых к розливу столовых сухих и полусладких вин, разрешенные в нашей стране, не обеспечивают их биологической стабильности. Поэтому для ее достижения необходимо применять дополнительную обработку (горячий розлив, бутылочную пастеризацию, стерилизующую фильтрацию и стерильный розлив или введение дополнительных консервантов).
Род Pichia Hansen.В сахарсодержащих средах дрожжи развиваются с образованием морщинистой пленки. Дрожжи этого рода обладают способностью усваивать сахара только путем окисления. Кроме того, они могут развиваться за счет окисления спиртов, органических кислот, поэтому хорошо растут на поверхности уже сброженных субстратов - вина, пива и других напитков, содержание спирта в которых не превышает 12-13 % об. В молодых винах дрожжи р. Pichia могут встречаться в больших количествах, во много раз превышающих количество других дрожжей.
Дрожжи р. Pichia вызывают заболевание столовых вин («цвель») и помутнение вин, разлитых в бутылки. За счет содержания в этих винах минимальных количеств, сахаров, спирта, глицерина и органических кислот в присутствии кислорода воздуха они быстро развиваются и образуют осадок, который делает вино совершенно непригодным к реализации.
При развитии на поверхности вина в виде белой мучнистой пленки дрожжи р. Pichia значительно изменяют как состав вина, так и вкусовые его достоинства. В вине увеличивается количество летучих кислот, эфиров, во вкусе появляется несвойственный фруктовый и лекарственный тон, вино становится менее экстрактивным, слабее окрашенным. Продукты обмена дрожжей р. Pichia тормозят рост и снижают бродильную энергию шампанских и хересных дрожжей.
Пленчатые дрожжи, в том числе и р. Pichia, весьма устойчивы к сернистому ангидриду. Их развитие можно задержать введением в вино 500 мг/л сернистой кислоты. Они являются сильными восстановителями сульфатов и сульфитов до элементарной серы, часть которой может восстанавливаться в сероводород.
Из видов р. Pichia только вид P. alcoholophila (синоним - P. membranaefaciens) найден в винах. P. alcoholophila усваивают путем окисления глюкозу (фруктозу и маннозу), этиловый спирт, глицерин, уксусную, молочную, янтарную, яблочную (слабо) и винную (слабо) кислоты.
Род Hansenula Sydow. Дрожжевые организмы р. Hansenula так же, как и дрожжи р. Pichia, образуют характерную сухую, гладкую, позднее складчатую пленку серовато-белого цвета, высоковсползающую по стенкам сосуда.
На поверхности виноградного сусла дрожжи р. Hansenula развиваются быстро, образуя на 2-3 сутки пленку и осадок, вызывая одновременно брожение с образованием 2-3 % об. спирта. Клетки пленки отличаются от клеток осадка более удлиненной формой, наличием больших вакуолей и жировых включений, сильно преломляющих свет. В осадке клетки овальной или округлой формы.
На плотной среде образуются колонии сначала белые, матовые, сплошные, а затем – морщинистые.
Размножаются не только в сахарсодержащих средах, вызывая одновременно их окисление и брожение, но и в уже сброженных средах, содержащих спирта не более 13 % об., при доступе кислорода воздуха за счет окисления оставшихся сахаров, а также за счет спиртов и органических кислот. При этом кислая реакция субстрата может меняться на щелочную. При развитии дрожжей р. Hansenula в сахарсодержащих субстратах образуются этиловый, бутиловый и амиловый спирты, уксусная, масляная и янтарная кислоты, летучие эфиры (особенно уксусно-этиловый), придающие сброженному материалу резкий аромат. Способны развиваться на мезге в ходе брожения и на стенках бочек, пропитанных вином.
Дрожжи р. Hansenula являются представителями вредной микрофлоры брожения. Они вызывают помутнения вин. При розливе вина в бутылки с доступом воздуха при температуре 18-20 °С они быстро развиваются, образуя легко взмучивающийся осадок в бутылке.
Из видов р. Hansenula вид Н. anomala является одним из наиболее опасных сорняков спиртового брожения. В ягодных соках они окисляют винную кислоту, которая обычно не усваивается другими дрожжами.
Род Candida Berkhout.Дрожжевые организмы р. Candida относятся к пленчатым неспорообразующим дрожжам.
Развиваясь на поверхности вина при свободном доступе воздуха, они снижают содержание спирта и экстрактивных веществ, обогащая его летучими кислотами, придающими вину острый вкус. Вино теряет свежесть, становится плоским, с характерным ароматом и вкусом выветрившегося, жидкого и пустого («цвель вина»).
На винах с большим количеством продуктов обмена веществ дрожжей р. Candida хересная пленка не развивается. Многие штаммы этих дрожжей могут расти в винах, содержащих 9-12 % об. спирта, и вызывать помутнения вина в бутылках, образуя легко взмучиваемый осадок. В этих условиях дрожжи р. Candida развиваются в вине за счет небольших (сотые доли процента) количеств остаточных сахаров, спирта и органических кислот.
Род Schizosaccharomys Lindner. В практике виноградного виноделия эти дрожжевые организмы встречаются чрезвычайно редко. Однако при производстве плодово-ягодных вин, особенно яблочных, они хорошо размножаются и приносят большой вред производству, так как одновременно со сбраживанием сахара могут сбраживать яблочную кислоту в спирт и углекислый газ. Эти дрожжи развиваются не только за счет глюкозы и сахарозы, широко распространенных в природных субстратах, но и за счет осахаренных крахмалистых субстратов - мальтозы и декстринов. Окислительная способность у дрожжей этого рода развита очень слабо. Они усваивают источники углеродистого питания главным образом в процессе брожения.
Дрожжи Schiz. acidodevoratus помимо разрушения яблочной кислоты способны сбраживать сахара с образованием спирта (этанола) до 12 % об. Они чрезвычайно устойчивы к сернистому ангидриду, поэтому их рекомендуют иногда для биологической десульфитации. Дрожжи этого вида выносят без вреда для своей жизнедеятельности содержание в среде SO2 до 1000 мг/л. Высокая температура (70-80 °С) в течение 10-15 мин вызывает их гибель. При низких температурах (10-15 °С) дрожжи Schiz. acidodevoratus развиваются значительно медленнее, чем Sacch. vini.
Способность дрожжей р. Schizosaccharomyces использовать яблочную кислоту иногда применяют в виноделии для биологического кислотопонижения вин. Однако применение их часто не обеспечивает приемлемых дегустационных качеств вина.
Род Saccharomycodes Hansen.В нормально бродящих виноградных соках встречается редко, но очень часто - в сульфитированных винах и соках, содержащих от 80 до 120 мг/л свободной сернистой кислоты. Можно использовать эти дрожжи для возбуждения брожения высокосульфитированных соков (для десульфитации) с дальнейшимо дображиванием винными дрожжами.
При брожении дрожжи этого рода образуют этанола в среднем 10 % об. Содержание летучих кислот и других вторичных продуктов идентично содержанию веществ, образуемых дрожжами р. Saccharomyces. Повышенная способность к синтезу уксусноэтилового эфира (80 мг/л при аэробном брожении и 200 мг/л - без доступа воздуха), придающего неприятный прокисший запах, не позволяет рекомендовать их для приготовления вин. Поэтому практически дрожжи р. Saccharomycodes относятся к вредным микроорганизмам вина. Они способны размножаться в винах, содержащих сахар и в консервированных сернистым ангидридом; в шампанском производстве могут тормозить вторичное брожение.
Род Hanseniaspora (Zikes) Klocker.ВидHanseniaspora apiculata является наиболее распространенным в природе сорняком брожения и во многих винодельческих районах составляет 90 % и выше всей микрофлоры сусла, поступающего на брожение. Некоторые расы сбраживают 6-7 % об. спирта; образуют много летучих кислот (до 1,5 г/л) и уксусноэтилового эфира (250 мг/л), муравьиную, янтарную, пропионовую и масляную кислоты. Эти продукты брожения сообщают виноматериалу не только посторонний тон, но и тормозят рост и бродильную энергию винных дрожжей, как при брожении виноградного сусла, так и при брожении вин (при шампанизации), являясь причиной недобродов. Шампанские виноматериалы, сброженные с участием дрожжей р. Hanseniaspora, после шампанизации труднее осветляются вследствие образования шампанскими дрожжами липнущих осадков, трудносмываемых «масок» на стенках бутылок, затрудняющих полное сведение осадка на пробку. Особенно опасно присутствие этих дрожжей в сусле, перерабатываемом на хересные виноматериалы, так как продукты их обмена тормозят рост хересной пленки на вине.
Дрожжи Hanseniaspora apiculata чувствительны к сернистому ангидриду. Введение 75 мг/л SO2 задерживает их развитие. Для удаления этих сорняков брожения была предложена Семишоном система «брожения свыше четырех», которая состоит в том, чтобы начинать брожение в среде, содержащей 3-4 % об. спирта. Однако эта система виноделия не привилась, поскольку преимуществ в достижении чистоты брожения недостаточно.
Дрожжи р. Hanseniaspora, таким образом, нежелательны в процессе приготовления вин, но некоторые авторы считают их полезными с точки зрения образуемых ими эфиров, сообщающих винам особый плодовый аромат.
Род Brettanomyces Kufferath.В виноградном виноделии широко распространены 2 вида: Вr. intermedius и Вr. custersii.
Вид Br. custersii обладает высокой спиртообразующей способностью: полностью сбраживает 18 % сахара в сусле с образованием 11-12 % об. спирта; спиртовыносливость ослаблена, и в вине, содержащем более 12 % об. спирта, рост культуры прекращается. Количество уксусноэтилового эфира, образуемого этими дрожжами, зависит от штамма и может быть очень большим, легко ощущаемым. Является сильным кислотообразователем, обогащает вино летучими и нелетучими кислотами с резким неприятным запахом уксусного амида, что делает вино совершенно непригодным для употребления.
Наиболее благоприятной средой для р. Brettanomyces является тиражное вино с 2 % сахара, поэтому наиболее часто эти дрожжи находят в шампанском виноделии. Они могут задержать и нарушить нормальный ход вторичного брожения, а также проведение ремюажа и дегоржажа. Вызывают они помутнения столовых вин, даже при добавлении сорбиновой кислоты, так как оказались очень устойчивыми к этому консерванту в противоположность другим родам и видам дрожжей.
Дрожжи этого рода относятся к термофильным, с оптимальной температурой роста 31-32 °С; при температуре ниже 12 °С рост их в вине прекращается. Дрожжи весьма чувствительны к SO2: при введении 100 мг/л полностью погибают.
Обычно поверхность виноградных ягод ко времени их созревания бывает обильно заселена не только дрожжами, но и бактериями. Однако развитие бактерий в сусле и вине ограничивается в связи с их высокой активной кислотностью, осмотическим давлением сахаров в сусле и спирта в вине. Поэтому в сусле и вине находятся только бактерии, способные развиваться при рН 2,5-4,5 и при концентрации спирта 12-18 % об.
Из всех известных групп бактерий существенную роль в виноделии играют молочнокислые и уксуснокислые бактерии, которые легко и быстро развиваются на поврежденных ягодах и, попав в сусло, при брожении сохраняются и развиваются в нем.
В настоящее время известно несколько видов и много рас уксуснокислых бактерий, развивающихся в вине.
Родовое название, предложенное Бейеринком для уксуснокислых бактерий - р. Acetobacter, в настоящее время является почти общепринятым и вошло в определители бактерий.
Клетки уксуснокислых бактерий палочковидной формы, иногда очень короткие, одиночные или соединены в длинные цепочки-нити, спор не образуют, грамотрицательны (рис.5.1).
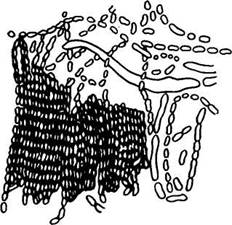
Рис.5.1. Дрожжи вида Acetobacter aceti
Средние размеры клеток (1,2-1,8)´(0,4-0,8) мкм. Обычно они встречаются в неподвижном состоянии. Но в молодой 24-48-часовой культуре многие клетки уксуснокислых бактерий подвижны, и при электронномикроскопическом просмотре отчетливо видны жгутики. Жгутик отходит от одного из полюсов клетки, часто субполярно, т. е. немного сбоку. Иногда наблюдается расщепление жгутика на 3-4 и более тонкие нити.
Неблагоприятные условия для развития уксуснокислых бактерий (высокие концентрации спирта - 15-16 % об., уксусной кислоты и других кислот - 10-11 %, высокая температура - в пределах 40 °С) нарушают процессы роста и деления клеток бактерий, вследствие чего изменяются их формы и размеры. При этом появляются характерные для уксуснокислых бактерий инволюционные формы: клетки-гиганты - очень длинные, в десятки раз длиннее и значительно шире, чем нормальные особи, иногда длиной до 30-40 мкм, со вздутиями, шаровидные, колбовидные, нитевидные, изогнутые. Инволюционные формы уксуснокислых бактерий неподвижны и лишены жгутиков. Количество сильно измененных клеток обычно увеличивается при повышении концентрации уксусной кислоты в среде до 2,0-4,5 %, при отклонении температуры и рН от оптимальных величин.
Уксуснокислые бактерии размножаются чрезвычайно быстро. Их число удваивается через каждые 30 мин. Из одной бактериальной клетки в течение 12 ч может возникнуть 17 млн. особей. Несколько клеток бактерий, помещенных на поверхности вина, за короткое время образуют 300 млрд. клеток - слой в 1 м2, общая масса их составляет 1 г. Такое количество уксуснокислых бактерий в течение нескольких дней может превратить в уксусную кислоту 10 кг спирта, т. е. «переработать» количество спирта, в 10000 раз превышающее их собственную массу.
Характерной чертой многих видов уксуснокислых бактерий является рост на поверхности питательной среды - образование пленки. Основной предпосылкой этого является относительная гидрофобность поверхности клеток и сцепление слоя клеток с открытой поверхностью среды на разных стадиях роста. При достижении достаточной толщины пленка опускается и начинает расти в глубине среды до тех пор, пока на поверхности не образуется новый слой, прекращающий доступ кислорода воздуха. Строение и внешняя форма пленки бактерий зависят от питательной среды и окружающих условий. Некоторые виды уксуснокислых бактерий образуют толстую пленку, другие тонкую, у одних она слизистая, у других - сухая. Общей особенностью пленки уксуснокислых бактерий является ее способность «всползать» на стенки стеклянной посуды.
Бактерии A. aceti, предпочитающие этиловый спирт и уксусную кислоту глюкозе и многоатомным спиртам, способные к синтезу всех необходимых им витаминов, быстро развивающиеся в средах с азотом в виде аммонийной соли, нашли широкое применение в производстве при скором (немецком) способе получения уксуса. Они окисляют спирт при рН 2,5-3,0, накапливая при этом до 10-11 % уксусной кислоты. Многие виды уксуснокислых бактерий способны превращать молочную кислоту в ацетоин.
Некоторые виды уксуснокислых бактерий обладают исключительно редким в мире бактерий биосинтезом полисахарида целлюлозы. Ферменты, участвующие в образовании этого полисахарида, содержатся в A. xylinum и A. acetigenum.
Уксуснокислые бактерии синтезируют целлюлозу из различных моно- и дисахаридов (арабинозы, ксилозы, рамнозы, глюкозы, фруктозы, галактозы, мальтозы, сахарозы и лактозы), из многоатомных спиртов (глицерина, эритрита, сорбита и маннита), из глюконовой, 2- и 5-кетоглюконовых кислот. A. xylinum в некоторых условиях образует целлюлозу при развитии за счет этилового спирта, уксусной, янтарной или L-яблочной кислот.
Обладая уникальной способностью к осуществлению аэробных окислительных реакций, уксуснокислые бактерии лишены способности к анаэробному расщеплению углеводов. Изучение ферментного аппарата их показало, что они имеют лишь некоторые ферменты, участвующие в гликолизе. Поэтому гликолитический путь расщепления углеводов не имеет значения в обмене веществ уксуснокислых бактерий. Кислоты вина - пропионовая, масляная и муравьиная — не используются уксуснокислыми бактериями. Одноосновная молочная кислота и двуосновные - янтарная, яблочная и винная - в большей или меньшей степени могут окисляться до углекислоты и воды. Частично эти кислоты используются бактериями как источник углеродного питания.
Заболевание вина.При заболевании вина уксуснокислые бактерии на его поверхности образуют пленку, которая по внешнему виду отличается от пленки, образуемой пленчатыми дрожжами. Цвет ее беловатый, иногда с голубым оттенком, она маслянистая, не рыхлая. К предметам, опущенным в вино, пленка не прилипает.
Уксуснокислые бактерии попадают в вино с поверхности оборудования и емкостей. Иногда они развиваются при изготовлении красных вин, когда ведут брожение на мезге с доступом кислорода воздуха. Медленное брожение, при котором поверхность среды недостаточно защищена выделяющимся углекислым газом от доступа воздуха, и повышенная температура способствуют развитию уксуснокислых бактерий и ускоряют образование уксусной кислоты, затрудняющей полезную работу дрожжей. В связи с этим опасность уксуснокислого брожения особенно велика при переработке винограда в теплую осень. Очень важно, чтобы спиртовое брожение наступило возможно скорее и сопровождалось обильным выделением СО2. Для этого надежным средством является брожение на сильной чистой культуре дрожжей и систематическое наблюдение за поддержанием благоприятной температуры.
Вина, в которых брожение закончилось, надо хранить без доступа воздуха в помещении при температуре, препятствующей развитию уксуснокислых бактерий. Необходимо следить, чтобы содержание свободной сернистой кислоты в вине оставалось на уровне 25 мг/л, и в случае его понижения снова доводить до этой нормы.
При обнаружении в вине уксуснокислого брожения, прежде всего надо приостановить этот процесс. Наиболее надежным способом для этого является пастеризация вина в течение нескольких минут при температуре 60-62 °С или фильтрация через обеспложивающий пластинчатый фильтр. Затем можно проводить купаж его с последующей сульфитацией внесением сернистого ангидрида в количестве 80-100 мг/л и хранить при низкой температуре в полных емкостях.
При хранении вин в металлических и железобетонных емкостях, заполненных ниже установленной нормы (недолитых), рекомендуется использовать герметизирующий состав с 2 % метабисульфита калия.
Тара и коммуникации, освобожденные из-под заболевшего вина, должны быть подвергнуты тщательной обработке в соответствии с технологической инструкцией по санитарной обработке винодельческих емкостей.
Неприятный царапающий вкус больного вина можно смягчить обработкой активным углем. Для этого в большинстве случаев бывает достаточным ввести 50-100 г угля на 10 дал вина. После обработки углем вносят сернистый ангидрид и проводят пастеризацию или фильтрацию вина через пластинчатый фильтр, так как только таким приемом можно окончательно удалить бактерии из вина. В большинстве случаев после обработки углем требуется купаж или обработка его осадочными дрожжами. Дрожжи должны быть здоровыми, чистыми. На 10 дал вина берут 5-10 л дрожжей.
Для исправления вкуса заболевших вин рекомендуется применять перебраживание на свежих выжимках. При этом выход спирта из единицы сахара в перебраживаемом вине увеличивается, поскольку уксусная кислота восстанавливается в спирты - пропиловый, бутиловый; 0,85 г летучих кислот могут повысить содержание спирта в вине на 0,1% об. Большой интерес представляет лечение вин с содержанием летучих кислот не более 3,0 г/л путем культивирования хересной пленки. Этот метод предложен Н. Ф. Саенко, но он требует внимательного микробиологического контроля, чтобы не допустить развития бактерий в пленке хересных дрожжей. Больное вино пастеризуют, фильтруют и доводят содержание в нем спирта до 14-14,5 % об. На поверхность вина наносят пленку чистой культуры хересных дрожжей.
Если в процессе уксуснокислого брожения в вине образовалось более 3 г/л летучих кислот, то его следует превратить в уксус или перегнать на спирт.
Молочнокислые бактерии имеют форму палочек или кокков, размеры которых зависят от состава среды и условий культивирования (рис.5.2).
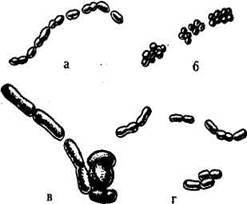
Рис.5.2. Форма клеток молочнокислых бактерий: а - кокки Leuconostoc oenos; б - кокки Pediococcus cerevisiae; в - палочки Lactobacillus casei; г - палочки Lactobacillus brevis
Палочковидные формы могут быть короткими, почти коккообразными, длиной 0,5-0,7 мкм и длинными нитевидными, иногда достигающими длины 8,0 мкм. Располагаются они единично, парами или цепочками, некоторые с характерными «обрубленными» концами.
Кокковые формы молочнокислых бактерий бывают овальными, диаметр клеток от 0,5-0,6 до 1 мкм. Они располагаются единично, парами или цепочками различной длины.
На форму клеток значительное влияние оказывает состав среды. Так, длина клеток молочнокислых бактерий увеличивается в средах с высоким содержанием этилового спирта. Этиловый спирт тормозит деление клеток сильнее, чем рост. Поэтому в спиртсодержащих средах палочки вытягиваются в длину, становятся тонкими, кокки сохраняют свою форму.
Молочнокислые бактерии размножаются путем простого деления. Бактериальная клетка увеличивается в размерах и делится на две одинаковых клетки. Деление клетки в одной плоскости приводит к образованию цепочек, в двух плоскостях - к образованию тетрад, характерных для р. Pediococcus. При благоприятных условиях некоторые бактерии дают новое поколение через 15 мин и менее, при неблагоприятных - через 24 ч и более.
Молочнокислые бактерии, встречающиеся в виноделии, неподвижны, не образуют спор, положительно окрашиваются по Граму, не образуют пигмент, не восстанавливают нитраты в нитриты, характеризуются неактивной каталазой. Протеолитическая активность установлена как у кокковых форм, так и у палочек и стрептобактерий, при этом палочковидные бактерии обладают большей активностью, чем кокковые формы. Обнаружены протеазы, разрушающие пептиды. Липолитической активностью обладают штаммы многих видов молочнокислых бактерий кокковых и палочковидных форм.
Основными веществами функциональной деятельности молочнокислых бактерий являются молочная кислота, спирты и летучие кислоты, диацетил и ацетоин и др.
Род Lactobacillus.К роду молочнокислых бактерий Lactobacillus относятся грамположительные неветвящиеся палочки, неподвижные, не восстанавливающие нитратов в нитриты, не образующие каталазы, сбраживающие углеводы с образованием молочной кислоты. Они характеризуются сложными потребностями в источниках питания, слабой дыхательной активностью, незначительным воздействием на белки и жиры, относительно кислотоустойчивы (способны расти при рН 3,8 и ниже), развиваются в анаэробных условиях.
Гетероферментативные палочки Lac. buchneri отличаются от Lac. brevis сбраживанием мелезитозы, Lac. fermenti отличаются от других гетероферментативных палочек тем, что не растут при температуре 15 °С, а растут при 45 °С. Гомоферментативные палочки Lac. plantarum отличаются от гетероферментативных сбраживанием целлобиозы, рамнозы, мелезитозы, маннозы и другими признаками
По энологической классификации имеется две разновидности Lac. plantarum: гомоферментативные бактерии, сбраживающие пентозы и разлагающие лимонную кислоту, и бактерии, разлагающие лимонную кислоту и не сбраживающие пентоз. Такая характеристика бактериальных видов удобна для практического виноделия.
Род Pediococcus.К р. Pediococcus относятся грамположительные, неспорообразующие, неподвижные кокки, располагающиеся единично, парами, кучками, тетрадами, но никогда цепочками; микроаэрофильные или анаэробные, часто требующие присутствия СО2 для роста, образующие D (-) молочную кислоту или смесь кислот D (-) и L (+), не восстанавливающие нитраты и нитриты, не разжижающие желатину, в основном не образующие каталазу, гомоферментативные. Некоторые штаммы продуцируют слизь из сахарозы.
В вине встречается вид Pediococcus cerevisiae - гомоферментативные кокки, не сбраживающие пентоз. Этот вид анаэробен и требует для своего роста присутствия углекислого газа. Всегда сбраживает глюкозу, фруктозу, маннозу, целлобиозу, трегалозу.
Гомоферментативные кокки, сбраживающие пентозы, относятся к виду Pediococcus pentosaceus.
Род Leuconostoc.Бактерии р. Leuconostoc относятся к гетероферментативным коккам, имеющим удлиненную яйцевидную форму; располагаются единично, парами или короткими цепочками. Особенностью лейконостоков является неспособность их образовывать из аргинина аммиак, как правило, они не имеют каталазы. При сбраживании углеводов наряду с молочной кислотой образуют СО2, этиловый спирт и летучие кислоты; некоторые штаммы образуют маннит из фруктозы. Растут при температуре 10 °С, но не при 45 °С.
Молочнокислое брожение вин (заболевание вин) вызывают молочнокислые бактерии. Они сбраживают сахара с образованием молочной и уксусной кислот. В заболевшем вине уменьшается содержание сахара, увеличивается титруемая и летучая кислотность. Иногда выделяется СО2.
Молочнокислому брожению подвергаются все типы вин, содержащие в своем составе то или иное количество сахаров, особенно малокислотные столовые с остаточным сахаром, крепкие и десертные с любым содержанием спирта, принятым в виноделии. Молочнокислые бактерии также могут использовать для развития альдегиды, глицерин, винную кислоту и др. Отсюда ясно, какой вред они наносят хересному производству, разлагая накопившиеся альдегиды.
Вино, в котором развивались молочнокислые бактерии, становится тусклым, теряет блеск. При встряхивании пробирки с вином появляются шелковистые волны (огромное скопление палочковидных бактерий). Внешний вид вина изменяется раньше, чем обнаруживаются другие признаки порчи. В дальнейшем вино приобретает неприятный сладковато-кислый вкус, своеобразный запах, напоминающий квашеную капусту. Иногда заболевание вина сопровождается появлением «мышиного привкуса». При глубоко зашедшем процессе, когда вино почти совсем испорчено, бактерии осаждаются на дно.
Процесс скисания вина наиболее активно вызывают молочнокислые палочки. Особенно большую опасность представляют ге-тероферментативные молочнокислые бактерии - Lac. brevis, Lac. buchneri и Lac. fermenti, менее опасны гомоферментативные - Lac. plantarum.
В настоящее время считают, что нет оснований выделять в отдельный вид заболевания вин, именуемые «турн» и «пусс», поскольку возбудители их чаще всего относятся к группе молочнокислых бактерий и симптомы заболеваний, такие, как наличие шелковистых волн, выделение СО2, изменение вкуса, идентичны молочнокислому скисанию. Предложено характеризовать заболевание вина изменением его определенной составной части или образованием нежелательных продуктов обмена. Например, «турн» - разложение винной кислоты, «прогоркание» - разложение глицерина, «маннитная болезнь» - превращение фруктозы в маннит. Такая характеристика заболеваний более стандартизована и заключает в себе конкретные сведения о происшедших в вине нежелательных изменениях.
Наиболее опасным заболеванием сахарсодержащих вин является гетероферментативное брожение, сопровождающееся обычно значительным повышением содержания летучих кислот (до 4 г/л) и накоплением молочной кислоты. Заболеванию подвергаются в основном малокислотные вина, возбудителями его являются гетероферментативные бактерии. Гомоферментативное брожение сахаров сопровождается значительным увеличением содержания молочной кислоты и повышением кислотности без повышения содержания летучих кислот. Оно может сопровождаться возникновением неприятно кислого вкуса и тонов «квашения». Источником этих пороков вина считают не молочную кислоту, а вторичные продукты, образуемые молочнокислыми бактериями при брожении. Возбудители брожения - гомоферментативные бактерии.
Замечено, что в результате молочнокислого брожения всегда появляются «квашеные» тона и вкус молочной сыворотки, а «мышиный тон» в отдельных случаях. Возникновение этого порока не является прямым следствием метаболизма в вине молочнокислых бактерий, а подготовляется сочетанием действия других факторов - определенной величины рН, установившейся в результате деятельности молочнокислых бактерий, и наличия железа.
Свойством разлагать фруктозу с образованием маннита обладают гетероферментативные молочнокислые бактерии. Они развиваются в малокислотных винах, содержащих сахар. При восстановлении фруктозы в маннит вино приобретает неприятный кисло-сладкий вкус. Маннитному брожению обычно сопутствует молочнокислое брожение сахаров, сопровождающееся повышением кислотности.
Разложение винной кислоты не является свойством одного какого-либо вида молочнокислых бактерий. Известно, что разлагать винную кислоту могут гомо- и гетероферментативные палочки и гетероферментативные кокки. Этим свойством обладают не все молочнокислые бактерии, а лишь отдельные штаммы. Процесс происходит в основном в малокислотных винах (рН 3,6). При разложении винной кислоты образуется уксусная кислота и углекислый газ. По другим данным, при разложении винной кислоты гомоферментативными палочками образуется молочная кислота и углекислый газ. Возможно, что разложение винной кислоты гомо- и гетероферментативными микроорганизмами происходит различными путями. При разложении винной кислоты кислотность вина уменьшается, появляется «плоскость» вкуса.
Свойством разлагать глицерин обладают отдельные представители всех видов молочнокислых палочек и кокков. Такие бактерии встречаются довольно редко. При разложении глицерина образуются уксусная, молочная и пропионовая кислоты, углекислый газ и остро пахнущий акролеин с резкими вкусовыми качествами. В красных винах акролеин в сочетании с полифенолами, в особенности с дубильными веществами типа эпикатехина, образует горькие вещества. Разложение глицерина происходит при средней кислотности вина (рН 3,3) и сопровождается ее повышением.
Молочнокислые бактерии в вине часто вызывают большее или меньшее повышение содержания летучих кислот. Наряду с уксусной кислотой, которая преобладает, в вине накапливаются пропионовая и муравьиная кислоты. Особенно интенсивно летучие кислоты образуются при гетероферментативном брожении сахаров, а также при разложении винной кислоты и глицерина. Значительное повышение летучих кислот, сопряженное с другими нежелательными изменениями в винах, приводит к необратимым изменениям качества вина. Если содержание летучих кислот в вине превышает 0,8-0,9 г/л, вино становится пустым и менее доброкачественным, хотя кислый привкус уксусной кислоты в нем еще не ощущается.
Однако возможны и менее значительные изменения состава вина, ведущие к увеличению летучих кислот в пределах допустимой нормы. Источники их образования необходимо иметь в виду при анализе изменения состава вина в процессе выдержки. Наблюдения показывают, что некоторое повышение содержания летучих кислот (на 0,1-0,2 г/л) происходит при нормальном биологическом кислотопонижении. Такое количество летучих кислот в значительно меньшей степени ухудшает качество вина, чем избыток яблочной кислоты.
Другим источником образования летучих кислот является разложение бактериями лимонной кислоты до молочной и уксусной и углекислого газа. Обычно оно происходит сразу после разложения яблочной кислоты. За счет сбраживания лимонной кислоты содержание летучих кислот в вине может увеличиться на 0,2 г/л. Поэтому для приготовления бактериальной разводки с целью кислотопонижения вина лучше отбирать штаммы, не разлагающие лимонной кислоты. При подкислении вин введением органических кислот необходимо помнить, что лимонная кислота легко атакуется бактериями.
Глюкуроновая кислота также разлагается молочнокислыми бактериями. Это объясняет ее отсутствие в некоторых винах. Галактуроновая кислота и полисахариды используются бактериями слабо.
Постоянным источником повышения летучих кислот являются и пентозы, всегда присутствующие в молодых винах. В среднем в винах содержится 0,7 г/л арабинозы и 0,16 г/л ксилозы. Гетероферментативные кокки могут потреблять арабинозу предпочтительно перед другими сахарами. Из 1 г арабинозы может образоваться 0,3 г летучих кислот (в пересчете на серную) и молочная кислота. Арабиноза сбраживается в основном кокками, ксилоза — палочками. Заслуживает внимания тот факт, что летучие кислоты образуются при сбраживании пентоз как гетероферментативными бактериями, так и гомоферментативными.
В процессе жизнедеятельности молочнокислые бактерии образуют кроме основных продуктов некоторое количество вторичных, оказывающих значительное влияние на сложение вина. К ним относятся диацетил, ацетоин и 2,3-бутиленгликоль.
Мало ощутимый во вкусовом отношении ацетоин (ацетилме-тилкарбинол) окисляется в диацетил, который ощущается во вкусе уже при концентрации 1:1000000. Пороговая концентрация ощущения диацетила в вине - 0,7-0,8 мг/л. Вина шампанские и сухие высокого качества содержат следы диацетила, вина среднего качества 0,4-0,8 мг/л, вина низкого качества - свыше 0,8 мг/л. Большие количества диацетила придают вину молочнокислые тона, тона квашения, переходящие в мышиный тон. Вино становится переокисленным, с грубым ароматом и вкусом. Диацетил и ацетоин образуются молочнокислыми бактериями и в процессе биологического кислотопонижения.
Скорость заболевания инфицированных вин зависит от их состава. Бактерии размножаются быстро в винах с низкой титруемой кислотностью, с высоким рН (выше 3,0), содержащих сахар, и, наоборот, размножаются медленно в более жестких условиях (низкая температура, рН ниже 3,0), вследствие чего признаки заболевания проявляются через несколько месяцев. В связи с медленным размножением и заторможенным накоплением продуктов обмена молочнокислые бактерии обладают высокой выживаемостью. Особенно долго живут бактерии в дрожжевых осадках. Высокие концентрации сахара тормозят развитие бактерий. При концентрации SO2 общей свыше 100 мг/л в сусле и 80 мг/л в вине молочнокислые бактерии не развиваются. Однако для остановки уже начавшегося заболевания, вызванного молочнокислыми бактериями, необходимо вводить SO2 в количестве 200 мг/л.
Молочнокислые бактерии, развиваясь в столовых сухих низкокислотных винах, также вызывают вредный процесс - заболевание, связанное с использованием бактериями яблочной кислоты, лимонной, глицерина. Вино становится мутным, плоским и резким во вкусе, приобретает квашеные и часто мышиный тона.
Лечение заболеваний вин, вызванных развитием молочнокислых бактерий, является трудоемким, требуются тщательная обработка вина и длительные наблюдения.
В процессе оклейки и обработки адсорбентами (рыбий клей, желатин, бентонит) с последующей фильтрацией из вина выводится основная масса бактерий. Однако перед этой технологической операцией необходимо ввести в вино сернистый ангидрид в таких количествах, чтобы остановить жизнедеятельность бактерий. Отфильтрованное вино также сульфитируют до содержания SO2 в количествах, допустимых в промышленности, или пастеризуют. Столовые вина, склонные к заболеванию и содержащие молочнокислые бактерии, следует пастеризовать при более высокой температуре (70-72 °С). Вина с высоким содержанием спирта (20-17 % об.) рекомендуется пастеризовать при температуре 50 °С, а десертные (16-14 % об.) - при температуре 55 °С. Вино перед пастеризацией должно быть осветлено путем обработки оклеивающими веществами или фильтрацией, но без доступа воздуха.
Хорошие результаты дает фильтрация вин через стерилизующие фильтр-пластины. Мутные вина перед фильтрацией через обеспложивающий фильтр необходимо оклеить и профильтровать через обычные фильтр-пластины.
От мышиного тона в больных винах избавиться очень трудно, практически невозможно. Такое вино считается испорченным и непригодным даже для получения коньячных спиртов, потому что неприятный тон переходит во все фракции отгона. Для лечения вин с незначительным мышиным запахом рекомендуется многократная переливка с проветриванием и последующей сульфитацией; оклейка и фильтрация; пастеризация с последующей оклейкой и фильтрацией; фильтрация через древесный уголь (но он одновременно выводит из вин красящие и ароматические вещества).
Для предотвращения развития молочнокислых бактерий в бутылочных винах необходимо своевременное проведение яблочно-молочного брожения с последующей обработкой, способствующей максимальному выведению бактерий из вин, предельная доза сульфитации с введением разрешенных антисептиков.
Ожирение, или ослизнение, вина - эта болезнь также вызывается развитием молочнокислых бактерий, проявляется она обычно в молодых белых малокислотных и малоспиртуозных столовых винах, бедных дубильными веществами и содержащих остаточный сахар.
Возникновение вязкости, ожирения, ослизнения вина связано с процессом кислотопонижения, однако природа веществ, вызывающих изменение консистенции, не была выяснена. Предполагается, что тягучесть вина возникает в результате развития гетероферментативных кокков, которые образуют вискозные полимерные углеводы.
Характерным признаком больного вина является вязкость. Оно льется медленно, струей, бесшумно. При глубоко зашедшем процессе вино становится слизистым, пустым, тягучим, похожим на яичный белок. Во вкусе чувствуется неприятная слизистость, однако первоначальный букет вина не исчезает.
Такие вина легко поддаются лечению. При слабом развитии ожирения слизь удаляют оклейкой, причем перед оклейкой в вино обязательно добавляют танин. Для лечения вина достаточно, например, применить сульфитацию, а затем удалить слизистые остатки бактерий, обрабатывая вино диатомитовым порошком. Однако сахар, оставшийся несброженным, может снова вызвать заболевание вина, поэтому после снятия вина с осадка необходимо провести его дображивание.
В вине плесневые грибы не размножаются, но вино, налитое в тару с запахом плесени или укупоренное заплесневевшими пробками, приобретает плесневелый тон и становится испорченным. Обычно винодел принимает меры, предупреждающие появление плесени на различных объектах винодельческого производства, но мало знает о распространенных на винограде и винзаводах видах плесневых грибов и об особенностях их биологии.
На винодельческих заводах во избежание появления нежелательной микрофлоры - плесневых грибов - следует соблюдать чистоту.
В винподвалах размножение плесневых грибов так же вредно, как и на винограде. Споры плесневых грибов родов Mucor, Aspergillus, Penicillium, обычно всегда находящиеся в воздухе, легко прорастают на остатках сусла и вина, своевременно не удаленных из емкостей, с оборудования, из шлангов. При размножении плесневые грибы образуют летучие вещества, которые при контакте с вином в нем растворяются и придают винам очень неприятный трудно устранимый плесневый тон.
Для предотвращения размножения плесневых грибов необходимо тару и оборудование сразу после освобождения от сусла и вина тщательно промыть водой. Внутренняя поверхность деревянной и железобетонной тары без защитных покрытий обычно пористая, пропитанная остатками вина или сусла, трудно вымываемыми из пор. При достаточной влажности внутренние поверхности в таких емкостях быстро плесневеют. Поэтому для предотвращения размножения плесневых грибов деревянную тару, находящуюся без употребления, после тщательной мойки окуривают сернистым ангидридом или хранят заполненной 0,1 %-ым раствором сернистой кислоты. Надежно устраняется пористость внутренних поверхностей железобетонных резервуаров при помощи синтетических защитных покрытий эполукс, эполор, эпросин, ХС-558 «В» и др.
Бродильные чаны протирают насыщенным раствором кальцинированной соды. Железобетонные емкости после тщательной мойки необходимо хранить с открытыми верхним и нижним люками. Приемы обработки заплесневевшей тары описаны в «Технологической инструкции по санитарной обработке винодельческих емкостей, оборудования винопроводов и помещений».
Одним из новых и перспективных направлений в современном виноделии является применение ферментных препаратов из плесневых грибов. Установлено, что обработка виноградной мезги ферментными препаратами грибов Aspergillus awamori (Пектаваморином П10Х, Пектаваморином Г10Х), Aspergillus foctidus (Пектофоетидином П10Х, Пектофоетидином Г10Х) и Botrytis cinerea (Пектоцинерином Г 10Х) ускоряет процесс отделения сусла, увеличивает его общий выход, ускоряет процесс осветления сусла и молодых виноматериалов, а также созревание вин.
В настоящее время изучается действие отдельных ферментных систем, входящих в состав препаратов, с целью оптимизации их состава для использования при производстве вин различных типов.
Ферментные препараты ускоряют процесс гидролиза белков и полисахаридов. Уменьшение количества полимеров в результате их гидролиза происходит в период осветления сусла, во время его брожения и дальнейшего хранения виноматериалов. Получаемые с применением ферментных препаратов виноматериалы быстрее о светляются, требуют меньше затрат при обработке и более стабильны к помутнениям.
Контрольные вопросы
1. Перечислите дрожжи, вызывающие порчу вина? Какие пороки они вызывают?
2. Как влияют уксуснокислые бактерии на качество вина?
3. Как влияют молочнокислые бактерии на качество вина?
4. Какова роль плесневых грибов в виноделии?
ЗАКЛЮЧЕНИЕ
В учебно-методическом пособии приведена классификация дрожжей, имеющих отношение к пищевой промышленности.
Приведены методики выявления органелл и клеточных включений, содержится информация, позволяющая определять возраст дрожжевых организмов по набору морфологических приз; методики определения культуральных свойств дрожжей, в том числе и физиолого-биохимических.
Описаны методы определения технологических показателей дрожжей в соответствии с требованиями нормативной документации.
Охарактеризованы чистые культуры микроорганизмов, применяемых в хлебопечении.
Приведена схема определения частоты прессованных хлебопекарных дрожжей с учетом выявления допустимых и недопустимых групп микроорганизмов.
Приведена информация о микроорганизмах, влияющих на процесс брожения тестовых полуфабрикатов, а также микроорганизмов-вредителей хлебопекарной продукции.
Приведена информация о микроорганизмах, влияющих на процесс брожения винного сусла, а также микроорганизмов-вредителей бродильных производств.
Приведены приемы и способы борьбы, как с вредителями бродильных производств, так и с вредителями хлебопекарной продукции.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ Ф Ф ЛИТЕРАТУРЫ
1. Квасников, Е.И. Дрожжи. Биология. Пути использования / Е.И. Квасников, Т.Ф. Щелокова. – Киев: Наук.думка, 1991. – 328 с.
2. Берри, Д. Биология дрожжей / Д. Берри. – М.: Мир, 1985. 96 с.
3. Афанасьева, О.В. Микробиологический контроль хлебопекарного производства / О.В. Афанасьева. – М.: Пищевая пром-сть, 1976. – 144 с.
4. Елецкий, И.К. Микробиология хлеба и мучных кондитерских изделий / И.К. Елецкий. М.: Пищевая пр-сть, 1987. – 104.
5. Сборник методик по генетике дрожжей-сахаромицетов / И.А.Захаров, С.А.Кожин, Т.Н.Кожина, И.В Федорова. – Л.: Наука, 1984. – 144 с.
6. Слюсаренко, Т.П. Лабораторный практикум по микробиологии пищевых производств / Т.П. Слюсаренко. - М.: Легкая и пищевая пром-сть, 1984. – 208 с.
7. Семушкина, Т.Н Микробиологический контроль гидролизно-дрожжевого производства / Т.Н. Семушкина, Н.И. Монахова, Л.А. Гусарова. – М.: «Экология», 1991. – 208 с.
8. Технохимический контроль хлебопекарного производства. – М.: ВНИИПП, 1996. – 396 с.
9. Биотехнология: Учеб. пособие для вузов : В 8 кн. / Под ред. Н.С. Егорова, В.Д. Самуилова. – М.: Высш. шк., 1987. – Кн. 5: Производство белковых веществ. – 142 с.
10. Борисова, С.В. Биология дрожжей: учебное пособие / С.В. Борисова, З.Ш. Мингалеева, О.В. Старовойтова, О.А. Решетник; Казан.гос.технол.ун-т – Казань, 2006. – 120 с.
11. Борисова, С.В. Дрожжи и их использование в промышленности: учебник для студентов технических вузов / С.В. Борисова, О.А. Решетник, З.Ш. Мингалеева. – Казань: ЗАО «Новое знание», 2006. – 300 с.
12. Борисова, С.В. Использование дрожжей в промышленности: учебное пособие / С.В. Борисова, О.А. Решетник, З.Ш. Мингалеева. – С.-Пб.: Изд-во «ГИОРД», 2008. – 216 с.
13. Бурьян, Н.И. Микробиология виноделия / Н.И. Бурьян, Л.В. Тюрина. – М.: Пищевая пром-сть, 1979. – 272 с.
14. Бабьева, И.П. Методы выделения и идентификации дрожжей / И.П. Бабьева, В.И. Голубев. – М.: Пищ. пром-сть, 1979. – 119 с.
15. Руководство к проведению лабораторных работ: метод. указания. – М.: изд-во ММТПП, 1986. – 96 с.
16. Пащенко, Л.П. Биотехнологические основы производства хлебобулочных изделий / Л.П. Пащенко. – М.: Колос, 2002. – 368 с.
17. Афанасьева, О.В. Микробиология хлебопекарного производства / О.В. Афанасьева. – С-Пб.: Береста, 2003. – 220 с.
18. Пучкова, Л.И. Технология хлеба, кондитерских и макаронных изделий. Ч.1. Технология хлеба / Л.И. Пучкова, Р.Д. Поландова, И.В. Матвеева. – С-Пб.: ГИОРД, 2005. – 559 с.
19. 74. Витавская, А.В. Биологическая защита хлеба от картофельной болезни / А.В. Витавская, Г.Н. Дудикова, К.А. Тулемисова. – Алматы: Бастау, 1998. – 240 с.
20. Квасников, Е.И. Дрожжи: Биология. Пути использования / Е.И. Квасников, И.Ф. Щелокова. – Киев: Наукова думка, 1991. – 322 с.
21. Журавлева, В.П. Микрофлора первичного виноделия в условиях Туркменистана / В.П. Журавлева.- Ашхабад: Ылым, 1970. - 74 с.
СОДЕРЖАНИЕ
| Введение | 3 |
| 1. Основные признаки дрожжей | 4 |
| 1.1. Классификация дрожжей | 4 |
| 1.2. Морфологические признаки дрожжей | 26 |
| 1.2.1. Выявление включений клетки | 27 |
| 1.2.2. Возрастные особенности дрожжевых клеток | 30 |
| 1.2.3. Определение количества мертвых дрожжевых клеток | 30 |
| 1.2.4. Способы вегетативного размножения | 31 |
| 1.2.5. Спорообразование у дрожжей | 32 |
| 1.3. Культуральные признаки дрожжей | 33 |
| 1.4. Физиолого-биохимические признаки дрожжей | 34 |
| 2. Технологические показатели дрожжей | 37 |
| 2.1. Определение влажности дрожжей (арбитражный метод) | 37 |
| 2.2. Определение кислотности дрожжей | 38 |
| 2.3. Определение стойкости дрожжей | 38 |
| 2.4. Определение подъемной силы | 39 |
| 2.5. Определение быстроты подъема теста | 40 |
| 2.6. Определение йодредуцирующих веществ в дрожжах | 40 |
| 2.7. Бродильная активность дрожжей | 41 |
| 2.7.1 Определение бродильной энергии спиртовых дрожжей | 42 |
| 2.7.2 Определение бродильной энергии пивных дрожжей | 43 |
| 2.7.1. Определение мальтазной активности хлебопекарных дрожжей | 43 |
| 2.7.2. Определение зимазной активности хлебопекарных дрожжей | 44 |
| 2.8. Определение осмочувствительности дрожжей | 45 |
| 3. Роль чистых культур в хлебопечении | 46 |
| 3.1. Роль дрожжей-сахаромицетов в хлебопечении | 46 |
| 3.2. Дрожжи и молочнокислые бактерии, используемые в хлебопечении | 49 |
| 3.3. Возбудители инфекции хлебопекарных дрожжей | 63 |
| 3.4. Выделение чистой культуры | 65 |
| 3.5. Определение качественного состава прессованных дрожжей | 66 |
| 4. Микроорганизмы – вредители хлебопекарного производства | 70 |
| 4.1. Выявление посторонней и вредной микрофлоры | 71 |
| 5. Микроорганизмы – вредители бродильных производств | 84 |
| Заключение | 104 |
| Список литературы | 105 |
| Содержание | 107 |
Печатается в авторской редакции
Лицензия № 020404 от 06.03.97
| Тематический план 2011 г. | |||
| Подписано в печать | Формат 60х84 1/16. | ||
| Бумага писчая. | Печать RISO. | 6,81 усл.печ.л. | |
|
| Тираж 100 экз. | Заказ “С” . | |
Издательство Казанского национального исследовательского
технологического университета
Офсетная лаборатория Казанского национального
исследовательского технологического университета
420015, Казань, К. Маркса, 68
Дата добавления: 2018-02-28; просмотров: 671; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
