На электродах протекают реакции 10 страница
 . (7.10)
. (7.10)
Уравнение (7.10) носит название предельной формы закона Дебая-Хюккеля и может применяться для описания свойств разбавленных водных растворов при ионной силе вплоть до J=0,02.
7.6. Произведение растворимости
Пусть насыщенный раствор какого-нибудь сильного электролита вида В2А3 находится в равновесии со своими кристаллами:
В2А3 кр. « 2В3+ + 3А2-.
Константа равновесия будет равна
 , (7.11)
, (7.11)
где аВ3+ и аА2- - активности ионов в растворе; АВ2В3 – активность электролита в осадке.
Так как АВ2В3 при каждой данной температуре постоянна, то и числитель правой части приведенного уравнения при данной температуре тоже является величиной постоянной:
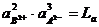 . (7.12)
. (7.12)
Постоянная La носит название произведения растворимости, если в растворе отсутствуют другие электролиты, образующие ионы, например в случае раствора AgCl, то
 .
.
Учитывая малую растворимость хлористого серебра, можно от активностей перейти к концентрациям. Тогда

и растворимость хлористого серебра равна
 .
.
Если к насыщенному раствору хлористого серебра прибавить электролит, содержащий один общий с ним ион, то увеличение общей концентрации, например ионов Cl-, вызовет уменьшение концентрации Ag+.
Прибавление электролита, не содержащего общих ионов, может влиять на растворимость электролита лишь в той степени, в которой возрастание ионной силы раствора будет вызывать изменение коэффициентов активностей и, следовательно, самих активностей.
|
|
|
7.7. Электролитическая диссоциация воды
Хотя вода часто рассматривается как вещество, практически не диссоциирующее на ионы, однако в действительности в очень малой степени вода всегда диссоциирует по уравнению Н2О « Н+ + ОН-.
Правда, необходимо помнить, что водородные ионы всегда образуют в воде ионы гидроксония Н3О+. Но для простоты обычно используют в качестве обозначения ион Н+, так как это не отражается на выводах. В растворах, содержащих кислоты, образуемые ими водородные ионы влияют на положение равновесия в реакции. В случае щелочей на равновесие влияют ионы гидроксила. Для Н2О:
 . (7.13)
. (7.13)
Для разбавленных растворов или для чистой воды вместо активности можно использовать концентрации:
 . (7.14)
. (7.14)
Степень диссоциации воды невелика, поэтому примем концентрацию ее постоянной и объединим с константой диссоциации воды в виде
Cн+ · Cон- = КВ,
где КВ – величина постоянная:
|
|
|
КВ = КД · CН2О . (7.15)
Эта постоянная носит название ионного произведения воды. При 25 оС ионное произведение воды КВ = 1,008 · 10-14. В чистой воде, а также в любой другой нейтральной среде Cн+ = Cон- (условие нейтральности), тогда
Cн+ = Cон-= 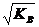 = 1,004 · 10-7 грамм-ионов в литре
= 1,004 · 10-7 грамм-ионов в литре
и, следовательно, степень диссоциации α равна
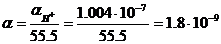 .
.
7.8. Концентрация водородных ионов
Однозначная связь между концентрациями ионов водорода и ионов гидроксила используется для характеристики кислотности и щелочности различных сред. Эти два понятия равнозначны, однако условились использовать для характеристики растворов активность водородных ионов. Практически используется не сама величина аН+, а так называемый водородный показатель рН, который определяется формулой
рН = - lgаН+, (7.16)
для разбавленных растворов
рН = - lgСН+. (7.17)
Водородным показателем называется величина, характеризующая активность (или концентрацию) водородных ионов и численно равная отрицательному десятичному логарифму этой активности (или концентрации, выраженной в грамм-ионах на литр). При 25 оС в нейтральной среде рН = 7, но с повышением температуры (поскольку реакция эндотермична) степень диссоциации повышается и наоборот:
|
|
|
- lgаН+ - lgаОН- = 14; - lgаН+ = рН; - lgаОН- = рОН.
рН + рОН = 14 рН = 1 рОН = 13.
Тогда для сильных кислот:
HCl ® H+ + Cl- C(HCl) = C(H+) (для разбавленных растворов)
pН = -lgCH+.
Для растворов сильных оснований:
NaOH® Na+ + OH-;
C (NaOH) = COH-; pOH = - lgCOH-;
pH = 14 – pOH = 14 + lgCOH-.
Слабые кислоты и слабые основания диссоциируют не полностью. Их способность к диссоциации определяется константой диссоциации и степенью диссоциации. В этом случае взаимосвязь между рН, рК и концентрацией слабой кислоты выглядит следующим образом:
КД и С СН3СООН « СН3СОО- + Н+
 ,
,
если [CH3COOH] = CK, то:
 ;
; 
-lg [ Н+] = ½ (-lgKД – lgCк);
рН = ½ рК – ½ lgCк .
Для слабых оснований
NH4OH « NH4+ + OH-
 ;
;

рОН = ½ рKосн –½ lgCосн; рН = 14 – ½ рKосн + ½ lgCосн .
Для слабых кислот существует следующая взаимосвязь между их концентрацией, степенью диссоциации и рН раствора:
рН = - lg (a× Ск).
В случае слабых оснований
pН = 14- рН = 14 + lga×Cосн .
7.9. Буферные растворы
Буферными растворами называются растворы с устойчивой концентрацией водородных ионов и, следовательно, с определенным значением рН, почти не зависящим от разведения и лишь слабо изменяющимся при прибавлении к раствору небольших количеств сильной кислоты или щелочи.
|
|
|
Такими свойствами обладают растворы, содержащие слабую кислоту или слабое основание совместно с их солью. Рассмотрим для примера раствор, содержащий уксусную кислоту и ацетат натрия. В этом случае процесс диссоциации характеризуется уравнением
 . (7.18)
. (7.18)
Присутствие ацетата практически полностью подавляет диссоциацию самой кислоты. Поэтому можно считать, что концентрация ССН3СООН практически равна исходной концентрации кислоты Ск. Концентрация ацетата равна концентрации a х Ссоли, т.е. произведению концентрации соли на степень ее диссоциации. В результате получим
 . (7.19)
. (7.19)
Для разбавленных растворов a = 1.
Тогда рН буфера будет:
 , (7.20)
, (7.20)
или
 , (7.21)
, (7.21)
или
 . (7.22)
. (7.22)
Для основных буферов:
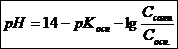 (7.23)
(7.23)
Величина рН – буферных растворов зависит:
Ÿ от показателя константы диссоциации слабой кислоты или слабого основания;
Ÿ от соотношения компонентов буферного раствора.
DрН = рК + 1 – зона буферного действия раствора.
В этом интервале значений рН наиболее четко поддерживается активная кислотность среды.
7.10. Механизм действия буферных растворов
При рассмотрении механизма действия буферов необходимо ответить на два вопроса:
Ÿ Почему рН буферного раствора не меняется при разбавлении?
Ÿ Почему рН буферного раствора не меняется при добавлении небольших количеств сильных кислот или сильных оснований?
При разведении константы диссоциации слабых кислот или оснований не меняются. Отношение концентраций кислоты и соли также остается постоянным. В результате рН сохраняется.
При добавлении сильной кислоты к буферу Н+-ионы реагируют с солевой компонентой и превращаются в недиссоциированную форму. Концентрация Н+ ионов уменьшается, концентрация слабой кислоты увеличивается, степень диссоциации уменьшается, а рН раствора практически не меняется.
При добавлении сильной щелочи ОН-–ионы реагируют с кислотой. Сильное основание заменяется на эквивалентное количество слабого электролита воды. Причины неизменения рН заключаются в превращении сильного основания в слабый электролит.
7.11. Буферная емкость
Буферной емкостью называется количество моль-эквивалентов сильной кислоты или сильного основания, которые можно добавить к 1 л буферного раствора, чтобы рН изменилась на одну единицу.
Буферная система крови. В норме рН крови находится в пределах 7,4 + 0,04. Хотя какой-то вклад в буферные свойства вносит гемоглобин и другие белки, а также фосфаты, все же главным компонентом буферной системы крови служит пара бикарбонат натрия/угольная кислота.
Элементы электрохимии Механизм возникновения скачков потенциала Механизм возникновения потенциала Нернста (электродный потенциал). Диффузионный потенциал, механизм возникновения и биологическая значимость.. Межжидкостный фазовый потенциал, механизм возникновения и биологическая значимость. Термодинамика обратимых электрохимических систем.
Введение в электрохимию
Электрохимия изучает химические реакции, протекающие под влиянием электрического тока, и процессы генерирования электрической энергии, происходящие в результате протекания химических реакций. Оба типа этих процессов сопровождаются взаимопревращениями электрической и химической энергии.
Все электрохимические процессы можно подразделить на две группы: процессы электролиза, при которых под воздействием внешнего источника электрической энергии происходят химические реакции, и процессы генерирования электрической энергии в результате протекания химической реакции.
В процессах первой группы электрическая энергия превращается в химическую. В процессах другой группы, наоборот, химическая энергия превращается в электрическую.
Примерами обоих типов могут служить процессы, протекающие в аккумуляторах. Так, при работе свинцового аккумулятора как генератора электрической энергии происходит реакция
Pb + PbO2 + 4H+ + SO42- ® 2PbSO4 + 2H2O.
В результате этой реакции выделяется энергия, которая и превращается в электрическую энергию. Если аккумулятор разрядится, то его заряжают, пропуская через него постоянный электрический ток в обратном направлении. В результате протекает химическая реакция
2PbSO4 + 2H2O ® Pb + PbO2 + 4H+ + SO42-.
В этом случае электрическая энергия превращается в химическую.
Все электрохимические реакции происходят при протекании электрического тока в цепи. Эта цепь слагается из последовательно соединенных металлических проводников и раствора (расплава) электролита. В металлических проводниках переносчиками тока являются электроны, в электролитах – ионы. Непрерывность протекания тока в цепи обеспечивается, если происходят процессы на электродах, т.е. на границе металл–электролит. Отличие электрохимических процессов от химических заключается в пространственном разделении процессов окисления и восстановления.
Основной характеристикой электрохимической системы является электродвижущая сила (ЭДС) – разность потенциалов между двумя металлическими электродами, которая измеряется при протекании обратимых процессов в системе.
Электрохимическая система, генерирующая электрическую энергию за счет протекающих в ней химических реакций, называется гальваническим элементом.
Процессы, при которых за счет электрической энергии от внешнего источника происходят химические превращения, называются электролизом. Электрод, на котором происходит процесс окисления, называется анодом, а тот, на котором происходит процесс восстановления, – катодом.
В гальваническом элементе анод обычно называют отрицательным полюсом, катод – положительным полюсом.
10.2. Термодинамика электрохимических систем
Электродвижущая сила гальванического элемента слагается из алгебраической суммы скачков потенциала на границах всех разнородных фаз системы:
| М1 | |||
| М1 | |||
| М2 | Эл II | Эл I | М1 |
На границе металл I – электролит I, электролит I – электролит II; электролит II – металл II и скачка потенциала на границе металл I – металл II (контактная разность потенциалов).
Если два металла замкнуты с помощью проводника (М III), то сумма скачков потенциала e (МI – MIII) +e (MШ – МII) равна скачку потенциала e (МI ‑ MII). Скачок потенциала на границе металл – раствор электролита является результатом перехода заряженных частиц через поверхность раздела фаз. При таком переходе, помимо химической работы, совершается работа электрическая. Соответственно состояние заряженной фазы в расчете на 1 моль компонента i характеризуется так называемым электрохимическим потенциалом `mi:
 = mi + zFFI, (10.1)
= mi + zFFI, (10.1)
где mi – химический потенциал I-го компонента данной фазы; zFFi – электрическая энергия 1 моль заряженных частиц этого компонента в данной фазе; F – число Фарадея, т.е. суммарный заряд одного эквивалента ионов, несущих заряд; z, Fi – разность электрических потенциалов между точкой внутри фазы и бесконечно удаленной точкой в вакууме, потенциал которой считается равным нулю.
Равновесие между заряженными частицами I-го компонента в двух фазах А и В наступает при равенстве их электрохимических потенциалов  . Отсюда для равновесия
. Отсюда для равновесия
 , (10.2)
, (10.2)
где Y – разность потенциалов между точками внутри фаз А и В; Y называется гальвани-потенциалом.
Скачок потенциала на границе металл – металл (межфазный гальвани-потенциал) возникает вследствие преимущественного перехода электронов из одной металлической фазы в другую. Его приравнивают к контактной разнице потенциалов. Скачок потенциала между двумя контактирующими жидкостями называется фазовым жидкостным потенциалом, если растворителем являются две несмешивающиеся жидкости. Если растворы различаются только природой или концентрацией электролита, то возникающая разность потенциалов называется диффузионным потенциалом.
Разность внутренних потенциалов между металлом и раствором называется нернстовским потенциалом. В общем случае ЭДС состоит из скачков потенциала между двумя металлами, двух нернстовских потенциалов (на границе металл – раствор) и гальвани-потенциала (раствор – раствор). Отметим, что контактная разность потенциалов не всегда входит составной частью в ЭДС. Так, если оба металлических электрода одинаковы, а оба электролита различны, то контактная разность потенциалов равна нулю. Нулю равен диффузионный потенциал в системах, в которых два металлических электрода находятся в контакте только с одним раствором электролита.
В соответствии с первым началом термодинамики взаимопревращение химической и электрической энергии происходит в строго эквивалентных количествах. Но если пропускать электрический ток через электролит, то не вся электрическая энергия превратится в химическую; часть ее превратится в теплоту в форме джоулева тепла q, которое равно
q = I2Rt, (10.3)
где q – количество теплоты; R – электрическое сопротивление электролита;
I – величина тока; t – время.
Если электрические процессы протекают термодинамически обратимо при силе тока I, равной нулю, то джоулево тепло не выделяется.
В этом случае гальванический элемент выполняет максимальную работу, которая равна изменению энергии Гиббса, взятому со знаком минус:
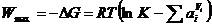 , (10.4)
, (10.4)
где К – константа равновесия реакции, ai – активность i-го участника реакции.
Электрическая работа равна работе химической реакции:
Wmax = –DG = zFE, (10.5)
где Е – ЭДС гальванического элемента.
Сопоставим (12.4) и (12.5):
 . (10.6)
. (10.6)
Для идеальных (разбавленных) растворов
 . (10.7)
. (10.7)
Дата добавления: 2018-02-28; просмотров: 357; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
