На электродах протекают реакции 7 страница
Однако в большинстве сложных реакций, протекающих через несколько стадий, когда общее стехиометрическое уравнение не отражает действительного хода реакции, показатели степени в уравнении скорости реакции не будут соответствовать стехиометрическим коэффициентам, т.е. закон действия масс для химических реакций выполняется лишь в некоторых частных случаях.
Можно утверждать, что стехиометрическое уравнение реакции, устанавливающее пропорции реагентов и продуктов, не определяет механизма протекания этой реакции во времени. Это является причиной, по которой экспериментально найденный порядок не всегда согласуется с уравнением, описывающим реакцию.
Множитель k в уравнении показывает, с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных 1 моль/л, и его называют константой скорости химического процесса. Он не зависит от концентрации и характеризует лишь влияние природы реагирующих веществ на скорость их взаимодействия друг с другом, т.е. константа скорости реакции является мерой реакционной способности молекул.
Размерность констант скорости реакции различного порядка легко получить из выражения для скорости реакции.
Нулевой порядок
 ; k0 = [C][t]-1. (8.6)
; k0 = [C][t]-1. (8.6)
Первый порядок
 ; k1 = [t]-1. (8.7)
; k1 = [t]-1. (8.7)
Второй порядок
 ; k2 = [C-1][t]-1. (8.8)
; k2 = [C-1][t]-1. (8.8)
|
|
|
Константы скорости реакций разных порядков имеют разные размерности и, поэтому их сравнение не имеет смысла. Хотя скорость некоторых химических реакций описывается кинетическим уравнением третьего порядка, однако это еще не значит, что они являются тримолекулярными. Все же укажем:
 ; k3 = [c]-2[t]-1 . (8.9)
; k3 = [c]-2[t]-1 . (8.9)
8.9. Молекулярность реакции
Молекулярность реакции определяется числом молекул, одновременно сталкивающихся и приводящих к химическим превращениям. Взаимодействие подобного рода носит название элементарного акта химического превращения, т.е. молекулярность реакции, в отличие от порядка реакции, имеет вполне определенный физический смысл. Например, реакция J2 = 2J – мономолекулярная, так как в ее основе лежит распад исходного вещества; реакция H2 + J2 = 2HJ – бимолекулярная; реакция 2NO + H2 = N2O + H2O является примером тримолекулярной реакции. Молекулярность более высокого порядка не встречается, так как одновременное столкновение четырех частиц почти невероятно.
В случае сложных реакций, протекающих в несколько стадий, нет смысла говорить о молекулярности реакции в целом, поскольку это понятие имеет отношение применимо только к отдельным стадиям.
|
|
|
Различие между молекулярностью и порядком реакции можно свести к следующему:
1) молекулярность реакции имеет вполне определенный физический смысл, а порядок реакции – величина формальная;
2) порядок реакции может принимать любые значения: целые, дробные и даже отрицательные, численные значения молекулярности ограничены лишь тремя цифрами – 1,2,3;
3) порядок реакции можно использовать для характеристики любых реакций (как сложных, так и простых), понятие «молекулярность» применимо только к элементарным актам химических превращений.
8.10. Количественные соотношения между скоростью
реакции и концентрацией реагента
В реакции первого порядка скорость реакции пропорциональна концентрации одного реагента. Для нее
 . (8.10)
. (8.10)
Для нахождения С в каждый момент времени t это уравнение необходимо проинтегрировать:
 ;
;  , (8.11)
, (8.11)
после интегрирования
ln c = - kt + const. (8.12)
Значение const находим из начальных условий, из которых следует, что С0 – начальная концентрация в момент времени t = 0. Определим постоянную как ln С0. Отсюда
|
|
|
ln С = - kt + lnC0; ln C – ln C0 = - kt; ln C/C0 = -kt (8.13)
или
 . (8.14)
. (8.14)
Заменив натуральные логарифмы на десятичные, получим:
 . (8.15)
. (8.15)
Особенность реакции первого порядка заключается в том, что равным промежуткам времени отвечают равные доли С0/С прореагировавшего вещества (рис. 8.2). Время t, нужное для того, чтобы прореагировала половина С0, называется периодом полупревращения: подставляя в уравнение t1/2 = t и С = С0/2, получим:
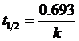 , (8.16)
, (8.16)
т.е. для реакции первого порядка период полупревращения t1/2 не зависит от начальной концентрации и служит характеристикой скорости таких реакций.

Рис. 8.2. Зависимость lgС от времени для реакции первого порядка
8.11. Реакция второго порядка
Выражение скорости для реакции второго порядка имеет вид:
 (8.17)
(8.17)
или
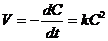 . (8.18)
. (8.18)
Разделяя переменные, получим:
 ; (8.19)
; (8.19)
|
|
|
после интегрирования:
 . (8.20)
. (8.20)
При C0 и t = 0 определяем постоянную интегрирования, равную 1/С0. Отсюда
 или
или  ; (8.21)
; (8.21)
 . (8.22)
. (8.22)
Период полупревращения для реакции второго порядка не остается постоянным, а обратно пропорционален начальной концентрации (рис. 8.3):
 . (8.23)
. (8.23)

Рис. 8.3. Зависимость 1/C от времени для реакции второго порядка
8.12. Уравнение скорости реакции третьего порядка
Хотя скорость некоторых химических реакций описывается кинетическим уравнением третьего порядка, это еще не значит, что они действительно тримолекулярные. Однако оно удобно для вывода кинетического уравнения:
 . (8.24)
. (8.24)
После интегрирования получим:
 или
или  , (8.25)
, (8.25)
если а – исходная концентрация, (а - х) – количество вещества, оставшегося ко времени t. Если реакция протекает по уравнению: 2А + В ® продукты и если [B] не равна [A], то интегрирование выражения для скорости реакции третьего порядка значительно усложняется.
8.13. Уравнение скорости реакции нулевого порядка
Если в уравнении скорости отсутствуют члены, содержащие концентрацию реагирующих веществ, то скорость такой реакции выражается уравнением нулевого порядка
 . (8.26)
. (8.26)
Реакция нулевого порядка представляет особый интерес в каталитических процессах, когда катализатор, взятый в определенном количестве, может служить фактором, лимитирующим скорость реакции. Такая ситуация встречается в ферментативной кинетике.
8.14. Определение порядка реакции
Порядок реакции играет существенную роль при изучении и раскрытии механизма реакции. Он в значительной степени зависит от механизма реакции. Порядок реакции определяется опытным путем, и его нельзя предсказать заранее, даже для реакций формально похожих.
а) Для определения порядка реакции часто используют способ подстановки. Он заключается в выборе уравнения кинетики реакции (нулевого, первого, второго порядков) при подстановке в которое экспериментальных данных получается постоянное значение константы скорости реакции.
б) Существует и графический способ определения порядка реакции. Например, для реакции нулевого порядка скорость реакции не зависит от концентрации. Для реакции первого порядка прямолинейной является зависимость lnC от времени. Для реакции второго порядка линейной будет зависимость 1/С от времени.
в) Используется также определение зависимости от концентрации константы полупревращения и т.д.
8.15. Теоретические основы химической кинетики
В основе современной химической кинетики лежат две теории: теория активных соударений и теория активного комплекса.
Теория активных соударений
Теория была сформулирована С. Аррениусом в 1889 году. В основе этой теории лежит представление о том, что для протекания химической реакции необходимо соударение между молекулами исходных веществ, а число соударений определяется интенсивностью теплового движения молекул, т.е. зависит от температуры. Но не каждое соударение молекул приводит к химическому превращению – к нему приводит лишь активное соударение.
Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называют энергетическим барьером реакции. Наглядное представление об энергетическом барьере реакции дает графическое изображение энергетики химической реакции (рис. 8.4).
В качестве абсциссы в этих диаграммах используется так называемая координата реакции. Вообще говоря, она является сложной функцией межатомных расстояний. Но для практических целей и простых молекул можно считать, что она характеризует изменения в межатомных расстояниях, которые происходят при сближении исходных молекул, образующих активированный комплекс, и взаимном удалении продуктов реакции при распаде активированного комплекса. По оси ординат откладывается потенциальная энергия всей системы.

Рис. 8.4. Энергетическая диаграмма реакции А+B = C+D
То дополнительное количество энергии, которое нужно добавить к средней энергии молекул исходных веществ, чтобы соударение стало активным, называется энергией активации.
Энергия активации ощутимо влияет на значение константы скорости реакции и ее зависимости от температуры: чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры. Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса:
 , (8.27)
, (8.27)
где А – так называемое «число соударений», которое представляет собой число соударений в одну секунду между одной молекулой вещества а и одной молекулой вещества В, заключенных в объеме в 1см3.
Однако наблюдаемые константы скорости реакции, как правило, гораздо меньше вычисленных по уравнению. Поэтому уравнение для константы скорости реакции видоизменяют следующим образом:
 , (8.28)
, (8.28)
где Z – теоретическое число столкновений, а Р – так называемый фактор вероятности или стерический, который учитывает все влияния, вызывающие отклонения от идеального уравнения. Необходимость ориентации может заметно тормозить даже сравнительно простые реакции. Хорошо изученным примером является реакция Н2 + J2 ® 2НJ.
Для того, чтобы простое соударение дало две молекулы йодистого водорода, надо, чтобы ориентация молекулы была сходна с той, которая изображена на рис. 8.5 а.

Рис. 8.5. Схема, отображающая значение благоприятной ориентации для того, чтобы простое соударение могло привести к образованию продукта реакции
Энергия активации этой реакции невелика, но скорость мала. Это связано с довольно жесткими требованиями, предъявляемыми к ориентации реагирующих молекул. Тогда А = РZ, т.е. а характеризует число соударений с благоприятной ориентацией и называется предэкспоненциальным множителем.
Используя уравнение Аррениуса, можно определить энергию активации Еа. Для этого уравнение Аррениуса удобно применять в логарифмической форме:
 (8.29)
(8.29)
или
 . (8.30)
. (8.30)
Если построить график lgk от 1/Е, то получим прямую, отсекающую на оси ординат отрезок, равный lgА, и имеющую тангенс угла, равный ‑ Еа/2,303R, т.е. tga = - Еа/2,303R, откуда Еа = -2,303 R tga.

Рис. 8.6. График Аррениуса
Из уравнения видно, что константа скорости реакции k является произведением двух сомножителей. Предэкспоненциальный множитель А практически не зависит от температуры, так как последняя не влияет на взаимную ориентацию молекул. Экспоненциальный множитель e-Ea/RT, который характеризует долю активных соударений от общего числа двойных соударений, сильно зависит от температуры.
Теория активных соударений внесла в химическую кинетику новые представления об активных соударениях и об энергии активации, но эта теория не рассматривала механизм самого соударения, что является ее недостатком.
8.15.2. Теория активированного (переходного) комплекса
(переходного состояния)
Эта теория – простейший и исторически первый вариант статистической теории химических реакций. Она разработана Э. Вагнером, М. Поляни, Г. Эйрнингом и М. Эвансом в 30-х годах XX века.
8.15.3. Вывод основного уравнения теории
переходного состояния
В основу теории также положено представление о столкновении молекул как непременном условии реакции. Но она рассматривает то, что происходит в момент столкновения.
Для реакции А + В = С в соответствии с теорией переходного состояния следует: А + В « х* ® С, где х* – переходной комплекс (пк). Что подразумевается под переходным комплексом? После столкновения молекул А и В начинается перераспределение химических связей и образование переходного комплекса. переходный комплекс представляет такое состояние взаимодействующих молекул, когда старые связи еще не полностью разорвались, а новые еще не полностью сформировались. В результате мы имеем состояние промежуточное между А, В и С. Переходное состояние характеризуется непрерывным изменением расстояний между взаимодействующими атомами. В этом существенное отличие переходного комплекса от обычной молекулы, в которой средние расстояния между атомами не зависят от времени. Переходный комплекс также не следует путать с промежуточными веществами. Он является динамической структурой, для образования которой требуется затрата энергии. Энергия, необходимая для перевода реагирующих молекул в состояние переходного комплекса, носит название энергии активации. Так как исходные молекулы еще не распались, то энергия перехода в активированное состояние меньше энергии разрыва связей в молекулах исходных веществ:
Еа < Едиссоциации.
Таким образом, формирование переходного комплекса – процесс энергетически более выгодный, чем полный распад вступающих в реакцию молекул. С другой стороны, превращение активированного комплекса в продукты реакции всегда является экзотермическим процессом.
Основной постулат теории переходного состояния заключается в том, что исходные вещества всегда находятся в равновесии с переходным комплексом:
А + в « х* ® С.
В этом случае k химического равновесия переходного комплекса равна:
 , (8.31)
, (8.31)
а концентрация х составит:
 . (8.32)
. (8.32)
Затем ПК распадается необратимо с образованием продукта С. Характеристикой (количественной) распада будет частота распада ПК – Р. Из статистической механики известно, что Р зависит только от температуры. Эта зависимость имеет вид Р = kТ/h, где k – постоянная Больцмана; h – постоянная Планка; Т – абсолютная температура.
Значит, для данной температуры число Р одинаково для всех переходных состояний, а скорость любой химической реакции определяется лишь концентрацией ПК:
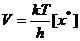 . (8.33)
. (8.33)
Концентрация ПК связана с концентрацией реагентов и поэтому, подставив их выражения, получим:
 . (8.34)
. (8.34)
К элементарной реакции взаимодействия применим закон действия масс:
V = kV[А][B], (8.35)
символ kV употребляется для константы скорости в отличие от константы Больцмана.
Приравняем правые части уравнений и получим:
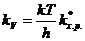 (8.36)
(8.36)
Дата добавления: 2018-02-28; просмотров: 346; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
