Химическое равновесие. Константа химического равновесия. Уравнение изотермы химической реакции
О химическом равновесии можно говорить при выполнении двух условий.
а) Во-первых, реакция является химически обратимой, т.е., в зависимости от условий, способна протекать и в прямую, и в обратную сторону.
б) Во-вторых, реакция находится в состоянии термодинамического равновесия: при имеющихся условиях не протекает фактически ни в одну сторону, но при малейшем воздействии может быть сдвинута в любую сторону.
Химическое равновесие характеризуется такой характеристикой химической реакции, как константа равновесия Кр. Это величина, определяющая для данной химической реакции соотношение между концентрациями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс), по значению Кр можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
С помощью кинетических уравнений прямой и обратной реакций выведем выражение для константы равновесия. Пусть происходит обратимая реакция:
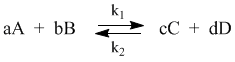
Здесь а, b, c, d – коэффициенты перед веществами в химических уравнениях прямой и обратной реакций. В этом случае можно записать кинетические уравнения:
vпр = k1[A]a[B]b; vобр = k2[C]c[D]d
При наступлении равновесия скорости прямой и обратной реакции становятся равны (vпр = vобр) и можно записать:
k1[A]a[B]b = k2[C]c[D]d
Из этого соотношения можно получить константу равновесия Кр, которая равна отношению констант скорости прямой и обратной реакций:
|
|
|

В предыдущем уравнении достаточно перенести в левую часть k2

а из полученного уравнения уже легко получается выражение для константы равновесия Кр:

Это не что иное, как математическая запись закона действующих масс для химического равновесия. Часто его формулируют следующим образом: отношение равновесных концентраций продуктов и субстратов (где концентрации взяты в соответствующих стехиометрических степенях) не зависит от исходных концентраций участников. Константа равновесия определяется экспериментально. Численное значение Кр характеризует положение равновесия при данной температуре и не меняется с изменением концентраций реагирующих веществ. Это значит, что независимо от исходных концентраций участников обратимой реакции (и реагентов, и продуктов), если реакция приходит к равновесному состоянию, отношение произведения конечных концентраций продуктов и реагентов оказывается всегда одним и тем же.
Запишем константу равновесия для гомогенной реакции


Для гетерогенной химической реакции концентрации конденсированных фаз (твердых или жидких) условно принимают равными единице и, таким образом, исключают из выражения.
|
|
|
Например, для реакции твёрдофазного восстановления оксида железа:
FeOт + COг = Feт + CO2г
константа равновесия (при условии, что газовая фаза идеальна) имеет вид:

Термодинамика дает важное соотношение между стандартной свободной энергией и константой равновесия, названное изотермой химической реакции
DG0 = -R T ln K = -2,3 R T lg K
Как видно из этих уравнений отрицательный знак DG0 возможен только в случае, если lgK > 0, т.е. К > 1, а положительный – если lgK < 0, т.е. К < 1.
Это значит, что при отрицательных значениях DG0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик, при положительном знаке DG0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал.
Знак DG0 указывает на возможность или невозможность протекания реакции только в стандартных условиях. Чем значительнее убыль энергии Гиббса, тем больше константа равновесия.
Дата добавления: 2018-02-28; просмотров: 2657; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
