Химическая термодинамика и её применение к биосистемам
7. Основные понятия термодинамики: система, параметры, состояние, процесс (определение, классификация, примеры). Внутренняя энергия. Энтальпия.
Химическая термодинамика – наука, изучающая энергетические эффекты процессов и условия устойчивости систем.
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы. Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделённая от других частей системы видимыми поверхностями раздела.
Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией.
Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы – параметры состояния. Опытным путем установлено, что для однозначной характеристики данной системы необходимо использовать некоторое число параметров, называемых независимыми; все остальные параметры рассматриваются как функции независимых параметров. В качестве независимых параметров состояния обычно выбирают параметры, поддающиеся непосредственному измерению, например температуру, давление, концентрацию и т.д. Всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния) есть термодинамический процесс. В зависимости от условий протекания различают следующие виды процессов:
Круговой или циклический – процесс, в результате протекания которого
система возвращается в исходное состояние. По завершении кругового процесса изменения любой функции состояния системы равны нулю.
Изотермический – процесс, протекающий при постоянной температуре.
Изобарный – процесс, протекающий при постоянном давлении.
Изохорный – процесс, при котором объем системы остается постоянным.
Адиабатический – процесс, происходящий без теплообмена с окружающей средой.
Равновесный – процесс, рассматриваемый как непрерывный ряд равновесных состояний системы.
Неравновесный – процесс, при котором система проходит через неравновесные состояния.
Обратимый термодинамический процесс – процесс, после которого системаи взаимодействующие с ней системы(окружающая среда) могут возвратиться в начальное состояние.
Необратимый термодинамический процесс – процесс, после которого система и взаимодействующие с ней системы(окружающая среда) не могут возвратиться в начальное состояние.
Основным свойством материи является то, что она находится в постоянном движении. Формы движения материи могут бытьразличными и определяются уровнем ее организации. Мерой движения и взаимодействия материальных систем является энергия. Полная энергия системы представляет собой сумму кинетической и потенциальнойэнергии системы как целого, так и ее внутренней энергии.
Внутренняя энергия системы – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как её полную энергию за вычетом кинетической и потенциальной энергии системы как целого.
Энтальпи́я, также тепловая функция , теплосодержание, энергия расширенной системы — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении. Энтальпия представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии.
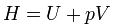
Энтальпия системы H — аналогично внутренней энергии — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
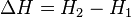
Дата добавления: 2018-02-28; просмотров: 2746; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
