Химическая кинетика и её значение для изучения скоростей и механизмов биохимических процессов
Классификация химических реакций. Реакции обратимые и необратимые, гомогенные и гетерогенные, экзотермические и эндотермические, простые и сложные, последовательные, цепные, сопряженные: определение, примеры.
Химические реакции, или химические явления, —это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению. Классификация химических реакций многопланова, то есть в ее основу могут быть положены различные признаки.
1.По направлению
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Необратимых реакций не так много. Большинство реакций являются обратимыми, т.е.одновременно протекающими в двух взаимно противоположных направлениях. В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
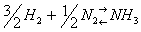 ,
,
2.По фазовому составу
Гомогенными называются реакции, которые идут в какой-нибудь одной фазе – газовой или жидкой. Например, это могут быть реакции между двумя газами, либо реакции, протекающие при сливании растворов:
NO2(г) + CO(г) = NO(г) + CO2(г);
|
|
|
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O
Реакции, происходящие на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами называются гетерогенными. Типичным примером гетерогенной реакции является лабораторный метод получения водорода из металлического цинка и разбавленной серной кислоты:
Zn(тв) + H2SO4(р-р) = H2(г) + ZnSO4(р-р)
3.По тепловому эффекту реакции делят на экзотермические и эндотермические.
Реакции, в которых энергия выделяется, называются экзотермическими. Реакции, идущие с поглощением энергии – эндотермические. Значение теплового эффекта соотносится с энергией связи молекул следующим образом:
ΔH = энергия, потраченная на разрыв связей — энергия, выделенная при образовании связей продуктов реакции. Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. Разрыв химических связей в эндотермических процессах требует большей энергии, чем может выделиться при образовании новых химических связей в молекулах. Для эндотермических реакций ΔH >0. Примером экзотермической реакци является внутримолекулярное окисление-восстановление дихромата аммония (NH4)2Cr2O7:
|
|
|
(NH4)2Cr2O7 = N2 + Cr2O3 + 4 H2O - ΔH.
Примером эндотермической реакции является разложение карбоната кальция:
СаСО3=СаО+СО2 + ΔH
4. По механизму химические реакции делят на простые и сложные. К простым относятся реакции, которые протекают только в одну стадию. Например, разложение галогенов:
I2= 2I.
Если же реакция протекает в несколько стадий, то она является сложной. Например, реакция разложения пероксида водорода записывается суммарным уравнением:
2Н2О2 = 2Н2О + О2
Однако эта реакция протекает в две стадии и является сложной:
1)Н2О2 =Н2О+О
2) О + О = О2.
Сложные реакции в свою очередь делят на последовательные, сопряженные,цепные.Последовательные - реакции с промежуточными стадиями типа А → В → С. Последовательные реакции распространены в природе и особенно часто они наблюдаются в биохимических процессах, протекающих в живых организмах, растениях. В качестве примера таких реакций можно привести фотосинтез и биологическое окисление глюкозы, гидролиз олиго- и полисахаридов и т.д.
Сопряженные - реакции, из которых одна протекает лишь совместно с другой. Например, Н2О2 легко окисляет соединения железа, но практически не окисляет бензол. Однако если провести эти реакции в общей смеси, то Н2О2 в этом случае окисляет и бензол:
|
|
|
Fe2+ + H2O2 = Fe3+ + OH-
OH- + OH- + C6H6 = C6H5OH + H2O.
Цепная реакция — химическая или ядерная реакция, в которой появление активной частицы (свободного радикала или атома в химическом, нейтрона в ядерном процессе) вызывает большое число (цепь) последовательных превращений неактивных молекул или ядер. Свободные радикалы и многие атомы, в отличие от молекул, обладают свободными ненасыщенными валентностями (непарным электроном), что приводит к их взаимодействию с исходными молекулами. При столкновении свободного радикала (R•) с молекулой происходит разрыв одной из валентных связей последней и, таким образом, в результате реакции образуется новый свободный радикал, который, в свою очередь, реагирует с другой молекулой — происходит цепная реакция. К цепным реакциям в химии относятся процессы окисления (горение, взрыв), полимеризации и другие.
Дата добавления: 2018-02-28; просмотров: 2167; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
