Буферные системы: определение, состав, классификация. Уравнения Гендерсона-Гассельбаха для расчета рН буферных систем
Буферными системами называются растворы, сохраняющие постоянное значение pH как при добавлении кислот и щелочей, так и при разведении. Раствор, содержащий одну или несколько буферных систем, называется буферным раствором. По своему составу буферные растворы - это смеси слабого электролита (основания или кислоты) и их соли, то есть буферные системы можно рассматривать как смесь слабого и сильного электролитов, имеющих одноименные ионы. По принадлежности слабого электролита буферной системы к классу кислот или оснований и по типу заряженной частицы они делятся на три типа: кислотный, основной и амфолитный.
Кислотные буферные системы представляют собой смесь слабой кислоты HB (донор протона) и ее соли B- (акцептор протона). Они, как правило, имеют кислую среду (pH <7). Примерами кислотных буферных систем являются:
Гидрокарбонатная буферная система (зона буферного действия pH 5,4-7,4) - смесь слабой угольной кислоты H2CO3 (донор протона) и ее соли HCO3- (акцептор протона).
Гидрофосфатная буферная система (зона буферного действия pH 6,2-8,2) - смесь слабой кислоты H2PO4- (донор протона) и ее соли HPO42- (акцептор протона).
Гемоглобиновая буферная система представлена двумя слабыми кислотами (доноры протонов) - гемоглобином HHb и оксигемоглоби-ном HHbO2 и сопряженными им слабыми основаниями (акцепторами протонов) - соответственно гемоглобинат - Hb- и оксигемоглобинат-анионами HbO2-.
|
|
|
Основные буферные системы представляют собой смесь слабого основания (акцептор протона) и его соли (донор протона). Они, как правило, имеют щелочную среду (pH >7). Примером основной буферной системы является:
Аммиачная буферная система: смесь слабого основания NH3•H2O (акцептор протона) и его соли - сильного электролита NH4+ (донор протона). Зона буферного действия при pH 8,2-10,2.
Буферные системы амфолитного типа состоят из смеси двух солей или из соли слабой кислоты и слабого основания, например CH3COONH4, в котором CH3COO- проявляет слабые основные свойства - акцептор протона, а NH4+ - слабая кислота - донор протона. Биологически значимой буферной системой амфолитного типа являются аминокислотные и белковые буферные системы общего состава (NH3+)m-Prot-(CH3COO-)n. Если аминокислоты или белки находятся в изоэлектрическом состоянии ИЭС (суммарный заряд молекулы равен нулю), то растворы этих соединений не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из ИЭС в форму “белок-кислота” или соответственно в форму “белок-основание”. При этом образуется смесь двух форм белка: а) слабая “белок-кислота” + соль этой слабой кислоты, б)слабое “белок-основание” + соль этого слабого основания.
Расчет рН буферных систем производят в соотвествии с уравнениями Гендерсона-Гассельбаха, устанавливающими зависимость между концентрацией [Н+], константой ионизации слабого электролита КИ, его сте6пенью диссоциации α и соотношением концентраций слабого электролита Сэ и его соли Сс.
|
|
|
Выведем уравнение Гендерсона-Гассельбаха на примере буферной системы кислотного типа - смеси уксусной кислоты и ее соли СН3СОONа. Концентрация ионов водорода в буферном растворе определяется константой ионизации уксусной кислоты:

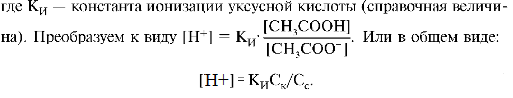
Уравнение показывает, что концентрация ионов водорода находится в прямой зависимости от КИ, α, концентрации кислоты Ск и в обратной зависимости от Сс . Логарифмируя обе части уравнения и взяв логарифм со знаком минус, получим уравнение Гендерсона-Гассельбаха для кислотной буферной системы в логарифмической форме:
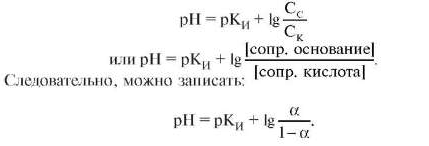
Для фосфатной буферной системы HPO42-/H2PO4- pH можно рассчитать по уравнению:
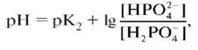
где K2 - константа диссоциации ортофосфорной кислоты по второй ступени.
Уравнения Гендерсона-Гассельбаха для буферных систем основного и амфолитного типов выводятся аналогично выводу уравнения для буферных систем кислотного типа и выглядят следующим образом:
|
|
|
для буферных систем основного типа:
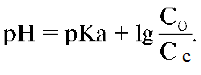
Данное уравнение можно представить в виде:
 ,
,
где Ка и Кв- соотвественно, константы кислотности и основности в сопряженной паре соль слабого основания – слабое основание, Со и Сс- концентрации основания и его .соли.
для буферных систем амфолитного типа
 ,
,
где К1 и К2 – константы кислотности слабого основания и слабой кислоты.
Уравнение Гендерсона–Гассельбаха позволяет сформулировать ряд важных выводов:
1. рН буферных растворов зависит от отрицательного действия логарифма константы диссоциации слабой кислоты рКа или основания рКв и от отношения концентраций слабого электролита и его соли, но практически не зависит от разбавления раствора водой. Постоянство рН хорошо выполняется при малых концентрациях буферных растворов. При концентрациях компонентов выше 0, 1 моль/ л необходимо учитывать коэффициенты активности ионов системы.
2. Значение рКа любой кислоты и рКв любого основания можно вычислить по измеренному рН раствора, если известны молярные концентрации компонентов. Кроме того, уравнение Гендерсона–Гассельбаха позволяет рассчитать рН буферного раствора, если известны значения рКа и молярные концентрации компонентов.
|
|
|
3. Уравнение Гендерсона–Гассельбаха можно использовать и для того, чтобы узнать, в каком соотношении нужно взят компоненты буферной смеси, чтобы приготовить раствор с заданным значением рН.
19. Механизм действия буферных систем при добавлении кислоты и щелочи (на примере ацетатной, аммиачной и белковой буферных систем), разбавлении водой.
Способность буферных смесей поддерживать практически постоянное значение рН раствора при добавлении кислоты и щелочи основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При разбавлении буфера водой рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными. Буферное действие прекращается, как только одна из составных частей буферного раствора (сопряженное основание или сопряженная кислота) полностью израсходуется.
Механизм действия буферных растворов кислотного типа рассмотрим на примере ацетатной буферной системы CH3COO-/CH3COOH, в основе действия которой лежит кислотно-основное равновесие
CH3COOH ↔ H+ + CH3COO- (KИ = 1,75•10-5).
Главный источник ацетат-ионов - сильный электролит CH3COONa. При добавлении сильной кислоты сопряженное основание CH3COO- связывает добавленные катионы водорода, превращаясь в слабую кислоту:
CH3COO- + H+ ↔CH3COOH (кислотно-основное равновесие смещается влево).
Уменьшение концентрации CH3COO- уравновешивается повышением концентрации слабой кислоты и указывает на процесс гидролиза. Согласно закону разведения Оствальда, увеличение концентрации кислоты несколько понижает ее степень электролитической диссоциации и кислота практически не ионизирует. Следовательно, в системе: Ск увеличивается, Сс и α уменьшается, [H+] - const, Ск/Сс увеличивается, где Cк - концентрация кислоты, Сс - концентрация соли, α - степень электролитической диссоциации.
При добавлении щелочи катионы водорода уксусной кислоты высвобождаются и нейтрализуются добавленными ионами OH-, связываясь в молекулы воды:
CH3COOH + OH- → CH3COO- + H2O (кислотно-основное равновесие смещается вправо).
Следовательно, Ск увеличивается, Сс и α уменьшается, [H+] - const, Ск/Сс уменьшается.
Механизм действия буферной системы основного типа рассмотрим на примере аммиачной буферной системы: NН4ОН (NН3 х Н2О) + NН4С1. Гидроксид аммония - слабый электролит, в растворе частично диссоциирует на ионы:
NН4ОН <=> NН4+ + ОН-
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы NН4С1 > NН4+ + С1- и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции. Поэтому С (NН4ОН) = С (основания); а С (NН4+) = С (соли).
При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами аммиака или гидроксида аммония. рН раствора при этом меняться не будет. При добавлении щелочи ионы ОН- будут связывать ионы NН4+, образуя при этом малодиссоциированное соединение NН4ОН , а не увеличивать рН раствора.
Механизм действия амфолитного белкового буферного раствора образованного кислой и солевой формами белка: при добавлении сильной кислоты ионы Н+ связываются солевой формой белка:
(NH3+)m-Prot-(COO-)n + nH+ ↔ (NH3+)m-Prot-(COOH)n,
Количество слабой кислоты при это незначительно увеличивается, а солевой формы белка – эквивалентно уменьшается. Поэтому рН остается практически постоянным.
При добавлении щелочи ионы Н+, связанные в "белке – кислоте", высвобождаются и нейтрализуют добавленные ионы ОН-
(NH3+)m-Prot-(COO-)n + mOH- ↔ (NH2) m- Prot-(COO-)n + mH2O.
Количество солевой формы белка при этом незначительно увеличивается, а "белка – кислоты" – эквивалентно уменьшается. И поэтому рН практически не изменится
Дата добавления: 2018-02-28; просмотров: 7069; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
