Константы нестойкости и устойчивости КЧ
В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений.
Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, т. е. практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно. Например, диссоциация комплексной соли [Ag(NH3)2]Cl протекает по следующим стадиям:
Первая стадия: [Ag(NH3)2]Cl  [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ + Cl-
Вторая стадия:1. Ag(NH3)2]+  AgNH3+ + NH3
AgNH3+ + NH3

2. AgNH3+ Ag+ + NH3
Ag+ + NH3

Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, в данном примере
 (9.1)
(9.1)
Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называетсяконстантой нестойкости. Обратная величина константы нестойкости называетсяконстантой устойчивости :
 (9.2)
(9.2)
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости. Так, среди соединений
| [Ag(NO2)2] - | [Ag(NH3)2] + | [Ag(S2O3)] - | [Ag(CN)2] - | |
| K нест | 1,3 · 10-3 | 5,8 · 10 -8 | 1,5 · 10 -9 | 1,4 · 10-20 |
устойчивость комплекса возрастает при переходе от [Ag(NO2)2] - к [Ag(CN)2] -.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH3)2] + Kнест = 5,8 · 10 -8, а для иона [Ag(CN)2] - Kнест = 1,4 · 10 -20, поэтому при действии раствора КСN аммиакат серебра разрушается с образованием иона [Ag(CN)2] - :
[Ag(NH3)2]Cl = 2KCN = K[Ag(CN)2] + 2NH3 = KCl
Зная константы нестойкости различных комплексов, можно теоретически вычислить концентрацию соответствующих простых ионов в растворах комплексных солей.
Пример 1.
Найти концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, если Kнест = 5,8 · 10 - 8.
Решение.
Обозначив искомую концентрацию Ag+ через х, из уравнения диссоциации комплекса [Ag(NH3)2]+ находим
[NH3] = 2x; 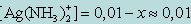
т. к. степень диссоциации комплекса незначительна. Следовательно, можно записать


От величины Kнест комплексного иона и KS осадка, который образует реактив с одним из продуктов распада комплекса, зависит, будут ли образовываться соответствующие осадки.
Пример 2.
Образуется ли осадок AgCl при прибавлении к 0,01М раствору [Ag(NH3)2]NO3 0,01М раствора KСl?
KS(AgCl) = 1,8 · 10 -10; Kнест[Ag(NH3)+2] = 5,8 10 -8.
Решение.
[ Ag+] = 5,25 ·10 -4 моль/л (см. пример 1), исходя из условия [Cl]- = 0,01 моль/л.
Для того чтобы выпал осадок AgCl, необходимо, чтобы
[ Ag+] · [Cl-]>KS(AgCl)
В данном примере
5,25 · 10 -4 · 10-2 = 5,25 · 10 -6 > 1,8 · 10 -10
Следовательно, осадок AgCl образуется.
При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант устойчивости образуемых ими комплексных соединений.
Например, катионы Ni2+, Co2+, Zn2+ дают устойчивые растворимые аммиакаты, а Al3+, Fe3+, Cr3+ менее склонны к комплексообразованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов.
26. Металлоферменты и другие биокомплексные соединения: гемоглобин и его производные, цитохромы, каталаза, пероксидаза, витамин В12 (пространственное строение, функции, электронное строение и тип гибридизации комплексообразователя)
Металлофермент- Фермент, имеющий в своем составе ионы металлов – тирозиназа (включает ионмеди), карбоангидраза и карбоксипептидаза (цинк), ксантиноксидаза (молибден), белки нитрогеназной системы азотфиксирующих бактерий (железо, молибден) и др.
Гемоглобин (Hb) - красный железосодержащий пигмент крови человека, позвоночных и некоторых беспозвоночных животных; в организме выполняет функцию переноса кислорода (O2) из органов дыхания к тканям; играет также важную роль в переносе углекислого газа от тканей в органы дыхания. У позвоночных и некоторых беспозвоночных находится в красных кровяных клетках — эритроцитах, составляя до 94% их сухого остатка.
Комплексообразователь имеет 
Электронное строение 
Hb — сложный белок — хромопротеид, состоящий из белка глобина и железопорфирина — гема. В геме центральным атомом является Fe2+, вокруг которого координированы 4 атома азота. У высших животных и человека Hb состоит из 4 субъединиц-мономеров

Цитохромы (гемопротеины) — это маленькие глобулярные белки (в первом приближении их структура может быть представлена в виде шара или вытянутого эллипсоида), которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками.
Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах. Цитохромы катализируют окислительно-восстановительные реакции. Биологическая функция Цит. заключается в переносе электронов и осуществляется (в процессе тканевого дыхания) путем обратимого изменения валентности атомов железа, входящих в состав гема (см. Гемоглобин).
Каталаза — фермент , который катализирует разложение образующегося в процессе биологического окисления пероксид водорода на воду и молекулярный кислород (2H2O2 → 2H2O + O2), а также окисляет в присутствии пероксида водорода низкомолекулярные спирты и нитриты. Содержится почти во всех организмах. Участвует в тканевом дыхании.
Фермент широко распространён в клетках животных, растений и микроорганизмов. Относится к хромопротеидам, имеющим в качестве простетической (небелковой) группы окисленный гем. Специфичность каталазы в отношении к субстрату-восстановителю невелика, поэтому она может катализировать не только разложение H2O2, но и окисление низших спиртов. Функция каталазы сводится к разрушению токсичного пероксида водорода, образующегося в ходе различных окислительных процессов в организме.
Пероксидаза - это фермент, который является катализатором в химической реакции восстановления воды из перекиси водорода и восстановителя.
Витаминами B12 (цианокобаламин) кобальтсодержащее биологически активное веществ, называемых кобаламинами. В В12 ион кобальта связан с 4мя лежащими в одной плоскости атомами азота пирроральных ядер.
В12 важен для обмена веществ. Он помогает формировать эритроциты и поддерживать в надлежащем состоянии центральную нервную систему. Витамин В12 помогает клеткам усваивать жиры, углеводы и белки. Гемоглобин состоит из глобина (высокомолекулярный белок). Состоит из 4 субъединиц (2 α и 2 β) К каждой спирали присоединён гемоглобин.
Гемоглобин КС железа (+2) с протопорфином(ароматический, небензоидный, плоский, макроциклический, состоящий из 4 гетероциклов, 5 членное соединение с 1 атомом N.
Соединения между гетероциклическими метиленовыми группами. Метиленовые группы не принимают участие в связи с Fe.
ПРОТОПОРФЕРИНОВОЕ КОЛЬЦО
Простое строение определяется типом гибридизации комплексообразователя Fe+2d2sp3 КЧ
Октаэдр
Каталаза, пероксидаза, цитохром С (ЦТХЗ) витамин B12(формула витамина!!!)
Является металоферментом
ЦТХС(формула в интерн.)
Основное отличие от гемоглобина- отсутствие переменного лиганда, то есть все лиганды(L) постоянны.
ЦТХС является католизатором различных реакций. Участвует в переносе энергии в митохондрии. Перенос энергии осуществляется благодаря реакции.
Гемоглобин - дыхательный пигмент, придающий крови красный цвет. Гемоглобин состоит из белка и железопорфирина и переносит кислород от органов дыхания к тканям тела и углекислый газ от них к дыхательным органам.
Цитохромы - сложные белки (гемопротеиды), осуществляющие в живых клетках ступенчатый перенос электронов и/или водорода от окисляемых органических веществ к молекулярному кислороду. При этом образуется богатое энергией соединение АТФ.
Кобаламины - природные биологически активные кобальторганические соединения. Структурной основой К. является корриновое кольцо, состоящее из 4 пиррольных ядер, у которых атомы азота связаны с центральным атомом кобальта.
Дата добавления: 2018-02-28; просмотров: 4175; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
