Зависимость скорости реакции от концентрации реагирующих веществ (закон действующих масс). Константа скорости
Закон действующих масс отражает зависимость скорости химической реакции от концентрации исходных веществ. Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:

закон действующих масс может быть записан в виде кинетического уравнения вида:
 (1)
(1)
где  — скорость химической реакции,
— скорость химической реакции,  — константа скорости реакции.
— константа скорости реакции.
Константа скорости k численно равна скорости реакции, если концентрации реагентов постоянны и равны единице.
Выражение (1) относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнениие ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Закон действующих масс безусловно выполняется только для элементарных химических реакций, протекающих в одну стадию.
14. Молекулярность и порядок реакции. Определение молекулярности сложной реакции. Кинетические уравнения реакций нулевого, первого и второго порядков.
Различают молекулярность реакции и ее порядок. Молекулярность реакции определяется числом молекул, участвующих в одном элементарном акте химического взаимодействия, причем имеется в виду только число реагирующих молекул, а не образующихся веществ. Молекулярность реакции указывает число молекул, в которых происходит изменение ковалентных связей в стадии, определяющей суммарную скорость реакции. Так, если в реакцию вступает одна молекула, то такая реакция называется мономолекулярной реакцией. Мономолекулярные – реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
|
|
|
I2 ––> I• + I•
Бимолекулярные – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):..
СН3Вr + КОН ––> СН3ОН + КВr
Тримолекулярные – реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО ––> 2NО2
Реакции более высокой степени молекулярности крайне редки из–за малой вероятности одновременного столкновения большого числа молекул. Молекулярность реакции легко определить только в случае простых реакций, протекающих в одну стадию.
Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально. Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции. Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
|
|
|
H2 + I2 → 2HI.
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции.
Порядок и молекулярность реакции совпадают только для простых реакпий, протекающих в одну стадию в соответствии со стехиометрическим уравнением. Объясняется это тем, что стехиометрическое уравнение реакции описывает процесс в целом и не отражает истинного механизма реакции, протекающей, как правило, через ряд последовательных стадий.
При исследовании сложных реакций пользуются принципом независимости, считая, что каждая из составляющих их простых реакций протекает независимо от других и описывается своим кинетическим уравнением. Общее кинетическое уравнение сложной реакции получают путём объединения кинетических уравнений составляющих её простых реакций с учётом скорости их протекания. В связи с этим такое уравнение часто содержит несколько констант скоростей и показатели порядка по каждому из реагентов в нём могут не совпадать со стехиометрическими коэффициентами, поэтому они определяется только опытным путём. Порядок в сложных реакциях может выражаться как целым, так и дробным числом и даже быть равным нулю.
Дробный порядок сложной реакции получается, если она включает в себя несколько лимитирующих стадий, протекающих с сопоставимыми скоростями, но имеющих разный порядок.
Нулевой порядок наблюдается в гетерогенных реакциях, протекающих на твёрдой фазе.
|
|
|
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:

Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Кинетическое уравнение реакции первого порядка:
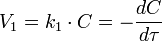
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
 или
или

Дата добавления: 2018-02-28; просмотров: 3384; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
