Примеры решения задач
Пример 1. С какими из указанных водных растворов (FeSO4, CuSO4 и Na2SO4) будет взаимодействовать никель при стандартных условиях? Написать  уравнения возможных реакций.
уравнения возможных реакций.
Решение. Металлический никель – восстановитель, т.е. Евос-ля = E0Ni2+/Ni = - 0,25 B. В общем случае окислителями в стандартных водных растворах солей могут быть не только катионы металла (с Еок-ля, равными в данной задаче E0 Fe2+ / Fe = - 0,44 B; E0Cu2+/Cu= + 0,34 В и E0Na+/Na = - 2,71, согласно табл. 1.1), но также вода или катионы Н+ (если соль подвержена гидролизу и в растворе ее рН < 5)
Их окислительный потенциал при рН = 5 – 7, рассчитанный по уравнению 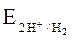 = - 0,059 pH, находится в интервале от −0,295 до −0,413 В. Поэтому условию Еок-ля > Eвос-ля (т.е. ΔG < 0) удовлетворяет только водный раствор соли CuSO4, из которого никель Ni в первую очередь должен восстанавливать катионы Cu2+ до металлической меди Cu.
= - 0,059 pH, находится в интервале от −0,295 до −0,413 В. Поэтому условию Еок-ля > Eвос-ля (т.е. ΔG < 0) удовлетворяет только водный раствор соли CuSO4, из которого никель Ni в первую очередь должен восстанавливать катионы Cu2+ до металлической меди Cu.
Уравнение реакции можно представить в ионно-электронной форме:
Ni – 2e = Ni2+ (окисление восстановителя),
Cu2+ + 2e = Cu (восстановление окислителя);
в ионно-молекулярной форме:
Ni + Cu2+ = Ni2+ + Cu;
в молекулярной форме:
Ni + CuSO4 = NiSO4 + Cu.
Пример 2. Вычислить электродный потенциал меди, находящейся в растворе сульфата меди с концентрацией ионов Cu2+ 0,001 моль/л.
Решение. Электродный потенциал металла вычисляется по уравнению Нернста. В табл.1.1 находим значение стандартного электродного потенциала E0Cu2+/Cu= + 0,34 В. Тогда ECu2+/Cu= 0,34 +  = 0,25 В (см. уравнение 1.6).
= 0,25 В (см. уравнение 1.6).
Пример 3. Вычислить электродный потенциал для водородного электрода при температуре 25 оС (Т = 298 K), парциальном давлении Н2 1 атм и рН = 3.
|
|
|
Решение. Уравнение Нернста для расчета потенциала водородного электрода в кислой среде 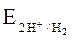 = - 0,059 рН. Вычисляем
= - 0,059 рН. Вычисляем  = - 0,059
= - 0,059  3 = - 0,017 В.
3 = - 0,017 В.
Пример 4. Вычислить потенциал кислородного электрода в растворе с концентрацией ионов Н+ 0.1 моль/л при температуре 25 оС и парциальном давлении О2 1 атм.
Решение. Одно из уравнений Нернста для расчета потенциала кислородного электрода в кислой среде имеет вид:
ЕO2+2H2O / 4OH- =Е 0O2+2H2O / 4OH-+ 0,059 рОН. Учитывая, что рН + рОН = 14 и pH= -  [H+], потенциал кислородного электрода можно вычислить как по данному уравнению
[H+], потенциал кислородного электрода можно вычислить как по данному уравнению
EO2+2H2O / 4OH- = 0,40+ 0,059х 13 = 1,167 ≈ 1,17 В (0.4 В = Е0 при рН = 14, см. табл. 1.1), так и по уравнению
Е = 1,229 – 0,059 рН = 1,23 – 0,059 = 1,17 В (1.23 В = Е0 при рН = 0, табл. 1.1).
Пример 5. Вычислить ЭДС гальванического элемента
Fe/ Fe(NO3)2 II AgNO3/Ag при концентрации раствора Fe(NO3)2 0,1 моль/л и концентрации раствора AgNO3 0,01 моль/л.
Решение. По уравнениям Нернста вычисляем Е электродов:
E Fe2+ / Fe = - 0,44 + 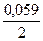
 10-1 = - 0,44 + (-0,0295) = -0,4695 B;
10-1 = - 0,44 + (-0,0295) = -0,4695 B;
E Ag+ / Ag = + 0,8 + 0,059  10-2 = + 0,7705 B.
10-2 = + 0,7705 B.
Следовательно, железный электрод является анодом, серебряный – катодом. ЭДС = Ек – Еа = + 0,7705 – (- 0,4695) = 1,24 В.
Пример 6. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если сплав находится в чистой влажной атмосфере (Н2О + О2)? Приведите схему образующегося гальванического элемента, напишите уравнения химических превращений на электродах и вычислите его ЭДС (для стандартных условий).
|
|
|
Решение. Находим значения стандартных электродных потенциалов Sn и Ag (табл. 1.1.):
E0Sn2+ / Sn = - 0,14 B; E0Ag+/Ag = +0,8 B.
Рассчитываем значение электродного (окислительно-восстановительного) потенциала окислителя для условий чистой влажной атмосферы – рН = 5.5 (или рОН = 14 – 5.5 = 8.5):
E0 O2+2H2O / 4OH- = 0,4 + 0.059 рОН = 0.4 + 0.059×8.5 = 0.90 B.
Олово является более активным металлом, чем серебро, и в образующейся гальванической паре будет анодом. Олово окисляется, а на катоде восстанавливается окислитель - кислород. Следовательно, на электродах данного гальванического элемента происходят следующие процессы:
А 2×½ Sn - 2 
 Sn2+
Sn2+
К 1×½ 2 H2O + O2 + 4 
 4OH-
4OH-
Схема образующегося гальванического элемента:
→ → → → 4  → → → _→ →
→ → → _→ →  →
→
Анод(-) 2Sn/2Sn2+½ H2O, O2½4OH-/2H2O + O2 (Ag)(+)Катод.
ЭДС = (ЕК – ЕА) = Е02H2O+O2 / 4OH-- E0Sn2+ / Sn = 0,90 - (- 0,14) = + 1,04 B.
Пример 7. Приведите уравнения анодного и катодного процессов, происходящих при коррозии стали: а) в кислой среде (без доступа кислорода), б) во влажной атмосфере (Н2О + О2).
|
|
|
Решение. Сталь содержит карбид железа (Fe3C), являющийся основной примесью. Карбид железа менее активен, чем железо, поэтому анодом является железо, катодом – карбид железа.
а) В кислой среде на аноде происходит процесс окисления железа, на катоде – восстановление ионов водорода:
Fe (анод) ½ Fe0 - 2 
 Fe2+
Fe2+
Fe3C (катод)½ 2H+ + 2 
 H2
H2 
б) При атмосферной коррозии стали электродах протекают следующие процессы:
Fe (анод) ½ Fe0 - 2 
 Fe2+
Fe2+
Fe3C (катод)½ 2H2O + O2 + 4 
 4OH-
4OH-
Дата добавления: 2015-12-21; просмотров: 104; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
