Химический потенциал. Правило фаз
Рассмотрим сначала однофазные (гомогенные) системы, состоящие минимум из двух компонентов. Примеры таких систем – смеси не взаимодействующих друг с другом газов, жидкие растворы.
Химический потенциал (μ) - это парциальная мольная энергия Гиббса, которая для каждого (i -го) компонента системы выражается частной производной энергии Гиббса (G) системы по числу молей этого компонента (ni) при постоянных температуре, давлении и числах молей других компонентов:
 . (1.17)
. (1.17)
Общая энергия Гиббса многокомпонентной системы может быть записана в виде
 . (1.18)
. (1.18)
Химический потенциал компонентов идеальной газовой смеси и идеального раствора выражается через стандартный химический потенциал (μi0 = Gi0 для чистого индивидуального вещества – компонента системы) и состав идеальной смеси
рi – парциальное давление газа в смеси или xi = ni / n – мольная доля компонента в растворе (n – общее число молей компонентов в растворе):
 . (1.19)
. (1.19)
Если в таких системах протекает химическая реакция, то известное Вам условие химического (термодинамического) равновесия (ΔG = 0), выраженное через изменение химического потенциала каждого компонента (dμi = 0) гомогенной многокомпонентной системы, описывается уравнением Гиббса-Дюгема:
 . (1.20)
. (1.20)
Подставляя (1.19) в (1.20), получаем знакомое Вам выражение, связывающее константу равновесия химической реакции (K) с изменением стандартной энергии Гиббса
|
|
|
Δ G х.р.0 = - RT ln K, (1.20а)
то есть при химическом равновесии в однофазной системе
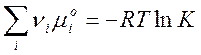 , (1.21)
, (1.21)
где νi – стехиометрический коэффициент в уравнении реакции перед соответствующим компонентом.
Cформулируем условия равновесия в многокомпонентных двух- и многофазных системах (гетерогенных). Такие равновесия называются фазовыми равновесиями.
Обозначим число фаз в системе как Ф. Число компонентов системы (обозначим как К) – это наименьшее число исходных веществ, достаточное для образования всех фаз системы, если вещества не вступают друг с другом в химические реакции.
В противном случае (если между веществами происходит химическая реакция) число компонентов будет иным:
К = числу исходных веществ за вычетом числа независимых реакций между ними.
В многофазной и многокомпонентной системе число параметров состояния (давление – p; температура – T; мольные доли - xi, т.е. состав), которые можно изменять в некотором интервале независимо друг от друга без изменения числа фаз, называется числом степеней свободы (n) или вариативностью системы.
Правило фаз Гиббса связывает число степеней свободы системы (число независимых параметров состояния - ν) с числом фаз (Ф) и числом компонентов (К) в системе соотношением:
|
|
|
n = K − Ф + 2. (1.22)
В многофазной и многокомпонентной системе условию фазового равновесия соответствует одинаковое значение химического потенциала каждого компонента системы во всех фазах.
Поэтому если для какого-то компонента химический потенциал в фазе (1) больше, чем в фазе (2), то происходит перенос этого компонента из (1) в (2) до тех пор, пока не установится равенство: μi (1) = μi (2) (верхние индексы относятся к фазам).
Если такой перенос невозможен (например, из-за наличия полупроницаемой мембраны, разделяющей раствор и чистый растворитель), то положительная разность химических потенциалов растворителя в чистом растворителе (1) и в растворе (2), т.е. условие (μi (1) - μi (2)) > 0, является причиной возникновения осмотического давления.
Дата добавления: 2015-12-21; просмотров: 24; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
