Опыт 3. Влияние хлорид - ионов на коррозию алюминия
Роль анионов Cl- (в больших концентрациях присутствующих в морской воде) как активаторов коррозии выражается в том, что они служат лигандами в комплексном ионе комплексообразователя Аl3+, что приводит к растворению прочных оксидных пленок на поверхности активных металлов из-за образования растворимой комплексной соли. Разрушение защитной оксидной пленки на поверхности алюминия приводит к контакту среды с поверхностью “чистого” металла Al0.
В две пробирки поместите по 1-2 кусочка алюминия и добавьте в одну из пробирок 2-3 мл раствора CuSO4 в другую – столько же CuCl2 той же концентрации. Убедитесь в том, что отношение Al к растворам взятых солей различно.
В пробирку, содержащую CuSO4, добавьте небольшое количество кристаллического NaCl. Что наблюдается?
Вопросы:
1. Доказав с помощью значений стандартных электродных потенциалов металлов термодинамическую возможность ОВ-реакции
Al + Cu2+ 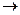 ……,
……,
объясните, почему данная ОВР идет только в присутствии ионов Cl-. Напишите уравнение реакции растворения оксидной пленки Al2O3 на поверхности Al за счет комплексообразования в молекулярной и ионной формах:
Al2O3 + 8NaCl + 3H2O ® ………..
2. Обратите внимание на изменение рН среды, в которой начинается ОВР – восстановление ионов Cu2+ алюминием и образование микрогальванических элементов (МГЭ).
3. Напишите схему процессов, протекающих на электродах образовавшихся микрогальванических элементов, с учетом рН среды при написании катодной полуреакции.
|
|
|
4. Сделайте вывод об особенностях влияния морской воды (содержащей ионы Cl-) на коррозию сплавов (в том числе – стали) по сравнению с пресной водой при прочих равных условиях.
Оформите результаты опыта в виде такой таблицы:
| Металл | Al | ||
| Электролит в растворе | CuSO4 | CuCl2 | CuSO4 + NaClкр. |
| Наблюдаемые явления | |||
| Ионно-электронные схемы процесса | а) реакция образования микрогальванических элементов: ………………….. б) процессы в микрогальванических элементах: …………………… | а) б) |
Опыт 4. Коррозия луженого и оцинкованного железа
Налейте в химический стакан 100 мл воды, добавьте 3-4 капли разбавленной серной кислоты и такое же количество раствора К3[Fe(CN)6]. Раствор перемешайте и разлейте поровну в две фарфоровые чашки. В одну из них поместите пластинку оцинкованного железа (с поцарапанным цинковым покрытием), в другую – железную пластинку с наплавленным кусочком олова. Важно, чтобы в обоих случаях коррозионная среда попадала на границу контакта двух разных металлов.
Заметьте время от погружения пластинок до появления синего окрашивания в коррозионной среде, т.е. до появления в ней ионов Fe2+ (cм. опыт 2).
|
|
|
Результаты опыта оформите в виде таблицы и ответов на вопросы.
| Электролит | H2SO4 | |
| Контактирующие металлы | Fe / Zn | Fe / Sn |
| Процессы на электродах в образующихся гальванических элементах в ионно-электронной форме |
Вопросы:
1. На основании схемы работы образующихся гальванических элементов объясните, в каком случае и почему скорость коррозии железа меньше - при контакте железа с цинком или с оловом? Укажите тип образующихся гальванических элементов.
2. Какое покрытие (Zn или Sn) для железа является анодным, какое катодным? Какое из покрытий надежнее защищает железо от коррозии после повреждения (нарушения) покрытия?
3. Начнет ли (и когда) корродировать в кислой водной среде железо, покрытое Zn, после повреждения покрытия? Если да, то напишите уравнение соответствующей окислительно-восстановительной реакции в ионно-электронной форме.
Дата добавления: 2015-12-21; просмотров: 112; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
