Реакции кислорода с металлами в присутствии
Водной среды
Если окислителем является кислород (О2, газ) при стандартном давлении (1 атм), окислительно-восстановительный потенциал которого может лежать в интервале
1.23 В ≥ 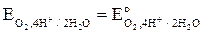 ≥ 0.40 В
≥ 0.40 В
в зависимости от рН (см. уравение 1.10), то окислению в водной среде при данном рН подвергаются те металлы, для которых
Е0М < 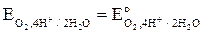 .
.
Очевидно (см. табл. 1.1), что это могут быть очень многие металлы – как с Е0 < 0, так и с Е0 > 0. В кислой водной среде (обычно при рН < 5.5) продуктом окисления металла является соль металла, а в почти нейтральной или щелочной среде (рН > 5.5) – гидроксид металла. Например, для двухвалентного металла ионно-молекулярная форма уравнений ОВ-реакции в зависимости от рН имеет вид:
2M + O2 + 4H+ = M2+ + 2H2O (при рН ≤ 5.5),
2M + O2 + 2H2O = 2M(OH)2 (при рН > 5.5).
Дата добавления: 2015-12-21; просмотров: 117; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
