И растворами щелочей
Окислителями для металлов в таких растворах могут быть катионы Н+ или молекулы Н2О, и реакция термодинамически возможна, если выполняется условие:
E0M < 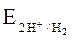 .
.
Значения потенциалов окислителя в таких реакциях и вид химического уравнения зависят от рН раствора.
При данном рН = 14 – рОН значение Еок-ля (потенциала водородного электрода) можно рассчитать по по уравнению Нернста (1.8). Уравнения реакций – такие же, как (1.14а) и (1.14б), то есть продуктами реакции являются газообразный Н2, а также соль или гидроксид металла в зависимости от рН.
Реакции молекулярного Н2 с растворами солей металлов
Газообразный водород (Н2(г) - атомы Н в степени окисления, равной нулю) является в большинстве ОВР восстановителем и окисляется. При подаче водорода в водный раствор соли металла (окислитель – катионы металла Mn+) реакция протекает в соответствии со схемой
Мn+ + (n/2) H2 = М + nH+.
Значение Ев-ля = Е0 = 0 (см. табл. 1.1). Поэтому термодинамически реакция возможна при выполнении условия EM(ок-ля) > 0.
При стандартных концентрациях катионов металла в растворе соли (1 моль/л) водород может восстановить до металла только катионы металлов, стоящих в ряду активности ниже водорода (с положительными значениями Е0, см. табл. 1.1).
Однако при нестандартных концентрациях растворов соли реальное значение потенциала окислителя (пары Мn+/M) нужно рассчитывать по уравнению Нернста (1.6) (иногда оно может оказаться отрицательным даже для тех металлов, которые ниже водорода в ряду активности).
Дата добавления: 2015-12-21; просмотров: 71; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
