Реакции металлов с раствором соли другого металла
Металлы (М0(1) - восстановители) в водных растворах солей других металлов могут окисляться не только катионами соли другого металла М(2)n+, но и катионами Н+ или молекулами Н2О (в зависимости от рН раствора). В соответствии с уравнением (1.12) реакция по схеме
М(1) + М(2)n+ = М(1)n+ + M(2)
возможна только в том случае, если выполняется соотношение:
E0M(1) < 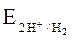 < EМ(2). (1.13)
< EМ(2). (1.13)
В стандартных условиях М(2) - это металлы, стоящие ниже (или правее) водорода в ряду активности (табл. 1.1), катионы которых М(2)n+ являются более сильными окислителями, чем катионы Н+ среды или молекулы Н2О.
Если условия не стандартные по концентрации соли, то для металла-восстановителя М(1) используется стандартное значение Е0, а потенциалы окислителей нужно вычислить по соответствующим уравнениям Нернста (уравнения 1.6 и 1.8).
Если оба металла стоят в ряду активностей (табл. 1.1) выше водорода (Fe, Sn, Zn, Al, Mn….) и характеризуются отрицательными стандартными потенциалами (Е0 < 0), т.е. выполняется условие
E0M(1) < E0М(2) < 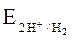 , (1.14)
, (1.14)
то более активный металл М(1) (восстановитель) из водного раствора соли другого металла будет восстанавливать не катионы металла М(2)n+, а катионы Н+ или молекулы Н2О до газообразного водорода Н2 в соответствии с уравнениями реакций при разных рН среды:
М(1) + nH+ = М(1)n+ + (n/2) H2 (при рН < 7), (1.14а)
2M(1) + 2n H2О = n H2 + 2 M(OH)n (при рН ≥ 7). (1.14б)
Для правильного написания уравнения реакции в этом случае достаточно знать характер среды (рН) в растворе соли металла М(2) (вспомните о реакциях гидролиза).
|
|
|
Дата добавления: 2015-12-21; просмотров: 90; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
