Электродные потенциалы. Уравнение Нернста
В кристаллической решетке металлов существует равновесие:
M ↔ Mn+ + ne, (1.1)
где М – атомы металла; Мn+ - ионы металла; е – свободные электроны, принадлежащие всему объему металла; n – число электронов на один атом.
При погружении металла в воду или водный раствор его соли, содержащий катионы Mn+ , поверхность металла может приобретать заряд того или иного знака (q) в зависимости от направления смещения равновесия (1.1), существовавшего в металле, и установления нового равновесия на границе металл / водная среда.
В чистой воде равновесие смещается вправо и поверхность металла приобретает нескомпенсированный отрицательный заряд q < 0 из-за избытка электронов (рис. 1.1).
При некоторой концентрации соли данного металла (ничтожно малой для металлов) равновесие не смещается при погружении металла в такой раствор и заряд поверхности отсутствует (q = 0). Раствор соли с такой концентрацией ионов металла можно считать “насыщенным” в отношении металла, а концентрация такого раствора называется концентрацией нулевого заряда – КНЗ (она составляет ~10-30 – 10-7 моль/л для разных металлов).
При всех реальных концентрациях соли металла, значительно превышающих КНЗ ([Mn+] >> КНЗ), равновесие (1.1) смещается влево, часть катионов металла из раствора встраивается в поверхностный слой кристаллической решетки металла и поверхность металла приобретает избыточный положительный заряд q > 0 (катионы металла играют роль потенциалопределяющих ионов для металлов в растворе своих простых солей).
|
|
|
В зависимости от наличия и знака заряда q на металле вблизи поверхности формируется равновесный ДЭС, состоящий из плотной и диффузной частей.
Плотная часть ДЭС образована ориентированными молекулами-диполями (Н2О или другими растворенными полярными молекулами) и разделяет поверхность металла и ионы в растворе, образующие противоположно заряженную “обкладку” ДЭС, рассматриваемого как электрический конденсатор.
При q > 0 – это анионы соли, притянутые кулоновскими силами к поверхности металла, а при q < 0 - катионы Mn+ (рис.1.1). При q = 0 плотная часть ДЭС образована только молекулами-диполями. Плотная часть ДЭС имеет ионно - адсорбционную природу и толщина ее определяется молекулярными размерами.
Диффузную часть ДЭС образуют катионы металла или анионы соли металла в растворе за пределами плотной части, которые полностью компенсируют (нейтрализуют) заряд поверхности металла. Толщина этой части ДЭС определяется расстоянием, на которое ионы способны удалиться от поверхности в результате теплового движения. Диффузная часть ДЭС имеет ионную природу.

Рис. 1.1. Схема образования равновесного двойного электрического слоя (ДЭС) на границе раздела фаз металл (Cu) / вода
|
|
|
Наличие ДЭС на границе металл / раствор электролита является причиной возникновения скачка электрического потенциала, называемого равновесным электродным потенциалом (Е, В), который является мерой изменения свободной энергии Гиббса (ΔG) при переносе потенциалопределяющих ионов (Мn+ в данном случае) через границу металл / раствор соли в прямом или обратном направлении (схема 1.1) и связан с этим изменением соотношением:
Е (В) = Δ G (Дж/моль) / n F (Кл/моль), (1.2)
где n – заряд одного иона или эквивалентное число электронов,
F = е NA = 96500 Кл/моль – число Фарадея – заряд, переносимый 1 молем электронов (е = 1.6×10-19 Кл – заряд электрона, NA = 6.02×1023 моль-1 – число Авогадро).
Реальное значение ΔG в заданных условиях связано со стандартным значением ΔG0 (при температуре 298 K и концентрациях компонентов в гомогенной системе 1 моль/л) cоотношением:
Δ G = Δ G 0 + RT ln[Mn+], (1.3)
где [Mn+] (моль ионов/л) – реальная равновесная концентрация ионов металла в системе металл – раствор его соли. Вспомните термодинамику: под знаком ln в этом уравнении стоит безразмерная величина (концентрация, отнесенная к стандартной, равной 1 моль ионов/л).
|
|
|
Значение электродного (окислительно-восстановительного) потенциала пары М / Мn+ в стандартных условиях называется стандартным равновесным электродным потенциалом металла и выражается как
Е 0(В) = Δ G 0(Дж/моль) / n F (Кл/моль). (1.4)
В таблице 1.1 приведены значения стандартных электродных потенциалов металлических электродов (Ео, В) в водном растворе простой соли данного металла. Данные табл. 1.1 – это по сути ряд восстановительной активности металлов в химических реакциях с растворами электролитов (известный Вам со школы ряд напряжений). Чем ниже располагается в нем металл (выше значение Е0), тем менее он активен как восстановитель в окислительно-восстановительных реакциях (труднее окисляется до Mn+) и тем активнее как окислитель катионы этого металла Мn+ (легче восстанавливаются до металла). Действительно, из соотношений 1.2 и 1.4 видно, что если переход ионов металла по схеме M - ne ↔ Mn+ происходит в прямом направлении (окисление металла), то ΔGпрям < 0 и Е < 0 (в соответствии с 1.2).
Таблица 1.1
Стандартные потенциалы металлических, водородного и кислородного электродов (при парциальных давлениях водорода и кислорода 1 атм), измеренные относительно стандартного водородного электрода
|
|
|
| Электрод | Электродный процесс | Ео, В |
| Li+ / Li | Li+ +е ↔ Li | - 3.04 |
| Rb+ / Rb | Rb+ +e ↔ Rb | - 2.925 |
| K+ / K | K+ +e ↔ K | - 2.925 |
| Cs+ / Cs | Cs+ +e ↔ Cs | - 2.923 |
| Ba2+ / Ba | Ba2+ +2e ↔ Ba | - 2.906 |
| Ca2+ / Ca | Ca2+ +2e ↔ Ca | - 2.866 |
| Na+ / Na | Na+ +e ↔ Na | -2.714 |
| Mg2+ / Mg | Mg2+ +2e ↔ Mg | - 2.363 |
| Be2+ / Be | Be2+ +2e ↔ Be | - 1.847 |
| Al3+ / Al | Al3+ +3e ↔ Al | - 1.662 |
| Ti2+ / Ti | Ti2+ +2e ↔ Ti | - 1.628 |
| Mn2+ / Mn | Mn2+ +2e ↔ Mn | - 1.180 |
| H2O / H2(газ) (OH-) | 2H2O + 2e ↔ H2 ↑ + 2OH- (pH = 14) | - 0.830 |
| Zn2+ / Zn | Zn2+ + 2e ↔ Zn | - 0.763 |
| Cr3+ / Cr | Cr3+ +3e ↔ Cr | - 0.744 |
| Fe2+ / Fe | Fe2+ +2e ↔ Fe | - 0.440 |
| Cd2+ / Cd | Cd2+ +2e ↔ Cd | - 0.403 |
| Co2+ / Co | Co2+ +2e ↔ Co | - 0.277 |
| Ni2+ / Ni | Ni2+ +2e ↔ Ni | - 0.250 |
| Sn2+ / Sn | Sn2+ +2e ↔ Sn | - 0.136 |
| Pb2+ / Pb | Pb2+ +2e ↔ Pb | - 0.126 |
| Fe3+ / Fe | Fe3+ +3e ↔ Fe | - 0.036 |
| 2H+ / H2(газ) | 2H+ + 2e↔H2 (pH = 0) | 0.00 |
| Sb2+ / Sb | Sb2+ +2e ↔ Sb | +0.200 |
| Bi3+ / Bi | Bi3+ +3e ↔ Bi | +0.220 |
| Cu2+ / Cu | Cu2+ +2e ↔ Cu | +0.337 |
| (H2O) O2 / 2OH- (OH-) | O2 + 2H2O +4e ↔ 4OH- (pH = 14) | + 0.403 |
| Hg2 2+ / Hg | Hg2 2+ +2e ↔ Hg | + 0.790 |
| Ag+ / Ag | Ag+ +e Ag | + 0.800 |
| Hg2+ / Hg | Hg2+ +2e ↔ Hg | + 0.854 |
| Pd2+ / Pd | Pd2+ +2e ↔ Pd | + 0.987 |
| Pt2+ / Pt | Pt2+ +2e ↔ Pt | + 1.190 |
| (H+) O2 / 2H2O | O2 + 4H+ +4e ↔ 2H2O (pH = 0) | + 1.229 |
| Au3+ / Au | Au3+ + 3e ↔ Au | + 1.498 |
| Au+ / Au | Au+ + e ↔ Au | + 1.691 |
Такие металлы могут cамопроизвольно окисляться в водной среде до ионов Мn+, но восстановить катионы этих металлов из раствора соли до металла в тех же условиях невозможно (ΔGобрат > 0 для восстановления).
Если катионы металла переходят в обратном направлении (восстанавливаются из раствора соли до атомов металла), то ΔGобр < 0. Перенос ионов из металла в раствор (окисление) для таких металлов невозможен в тех же условиях, так как ΔGпрям > 0. Соответственно, для таких металлов (неактивных) Е > 0.
В табл. 1.1 приведены также стандартные электродные потенциалы газовых электродов - водородного и кислородного, измеренные при парциальном давлении газа 1 атм и при стандартной концентрации либо ионов водорода в водном растворе [Н+] = 1 моль/л (то есть при рН = 0), либо анионов гидроксила [OH-] = 1 моль/л (то есть при рН = 14). В газовых электродах значение Е (В) характеризует перенос соответствующих ионов через границу газ (Н2, О2) / водный раствор кислот или оснований с соответствующим значением рН.
Значения электродных потенциалов для нестандартных условий (например, для нестандартной концентрации раствора соли металла в случае металлических электродов или для любого значения рН водного раствора в случае газовых электродов) можно рассчитать по уравнению Нернста. Это уравнение выражает зависимость равновесного окислительно-восстановительного (ОВ) потенциала ОВ-пары от концентрации окисленной и восстановленной форм данного атома и имеет вид (вспомните курс общей и неорганической химии):
Е = Е о + (RT / nF) ln{ [ок]равн / [вос]равн }, (1.5)
где [ок]равн и [вос]равн – равновесные концентрации окисленной и восстановленной форм определенного атома (в моль/л), а соотношение равновесных концентраций определяет величину константы равновесия полуреакции (п/р) окисления-восстановления в заданных условиях: К (п/р) = [ок]равн /[вос]равн.
Для металлических электродов в растворе соли данного металла уравнение Нернста легко получить, разделив обе части уравнения (1.3) на nF и заменив ΔG/nF и ΔG0/nF в обеих частях на Е и Е0 соответственно (формулы 1.2 и 1.4).
При Т= 298 К после подстановки численных значений констант в системе СИ и перехода к десятичным логарифмам уравнение Нернста для металлических электродов приобретает вид:
Е = Е о + (0.059 / n) lg[Mn+]. (1.6)
Аналогично можно вывести соответствующие уравнения Нернста для расчета равновесных электродных потенциалов водородного и кислородного электродов в зависимости от рН водного раствора.
Для водородного электрода, т.е. для полуреакций, в которых окисленной формой водорода являются ионы Н+ (кислая среда, рН < 7 – 1.7а) или молекулы Н2О (щелочная среда, рН > 7 – 1.7б), обратимый процесс восстановления – окисления записывается так:
2Н+ +2e ↔ H2, (1.7а)
2Н2О + 2e ↔ H2 + 2OH-. (1.7б)
Соответствующее уравнение для расчета потенциала имеет вид:
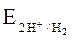 = Ео + (0.059 / 2) lg[ H+ ]2 = - 0.059 рН, (1.8)
= Ео + (0.059 / 2) lg[ H+ ]2 = - 0.059 рН, (1.8)
где Ео = 0 – стандартное значение потенциала водородного электрода при [Н+ ] = 1 моль/л (рН=0, [OH-] = 10-14 моль/л). Поэтому водородный электрод (платина, насыщенная газообразным водородом при его давлении 1 атм, погруженная в раствор Н2SО4 c концентрацией ионов Н+ 1 моль/л) служит электродом сравнения при практическом определении Е0 всех других электродов (окислительно-восстановительных пар).
Если в водородном электроде электролитом является водный раствор со стандартной концентрацией ионов OH- (то есть [OH- ] = 1 моль/л, [Н+ ] = 10-14 моль/л, pH = 14), то рассчитанное по уравнению (1.8) значение Е = - 0.83 В тоже является по сути стандартным значением потенциала водородного электрода, если парциальное давление водорода составляет 1 атм, и поэтому внесено в табл. 1.1.
Для кислородного электрода, т.е. для полуреакций, в которых восстановленной формой кислорода являются молекулы Н2О (в кислой среде, рН < 7 – 1.9а) или ионы OH- (нейтральная или щелочная среда, рН ≥ 7 – 1.9б), обратимое восстановление – окисление записывается в таком виде:
O2 + 4Н+ + 4e ↔ 2H2O, (1.9а)
O2 + 2Н2О + 4e ↔ 4OH-. (1.9б)
Уравнение Нернста для расчета потенциала кислородного электрода (при р = 1 атм) имеет вид:
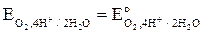 + (0.059 / 4) lg[ H+ ]4 = Ео - 0.059 рН, (1.10)
+ (0.059 / 4) lg[ H+ ]4 = Ео - 0.059 рН, (1.10)
где Ео = + 1.229 В - стандартное значение потенциала кислородного электрода при [Н+ ] = 1 моль/л и рН=0 (табл. 1.1).
При стандартной концентрации ионов OH- ([OH- ] = 1 моль/л, т.е. [Н+ ] = 10-14 моль/л и pH = 14) рассчитанное по уравнению (1.10) значение потенциала Е = 0.403 В тоже является по сути стандартным значением (табл. 1.1).
Дата добавления: 2015-12-21; просмотров: 124; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
