Расчет рН в растворе кислых солей
В водном растворе кислой соли одновременно будут протекать следующие процессы:
H2O  H+ +OH- H+ +OH-
| 
|
HAn-  An2- + H+ An2- + H+
| 
|
HAn- + H+  H2An H2An
| 
|
где K1, K2 – константы диссоциации H2An по 1-й и 2-й ступеням.
Концентрация Н+ - ионов складывается из концентрации [H+] - ионов, образующихся при диссоциации HAn- и Н2О, за вычетом ионов [H +], связывающихся в Н2Аn.
После математических преобразований получают следующие выражения для [H +] и рН:


Пример.
Вычислить рН в 0,01 М растворе NaHCO3.
Решение:
р K1 = 6,35; р K 2 = 10,32;

В аналитической практике, при использовании различных солей, необходимо учитывать возможность протекания гидролиза.
Необходимо учитывать, что связывание одного из продуктов гидролиза усиливает гидролиз, а введение в раствор продуктов, получающихся при гидролизе, его подавляет.
Например, в ходе анализа смеси Na+, K+, NH4+, Mg2+ после выпаривания раствора удаляют осадок основного хлорида MgOHCl, образующегося в результате гидролиза соли магния:
MgCl2 +H2O  MgOHCl + HCl
MgOHCl + HCl
При осаждении Fe 2+, Fe 3+, Zn 2+, Mn 2+ действием сульфида аммония (NH4)2S необходимо добавить NH4OH для подавления гидролиза(NH4)2S:
(NH4)2S + +H2O  NH4HS +NH4OH
NH4HS +NH4OH
Кроме того, необходимо учитывать, что введение гидролизующихся солей может привести к существенному изменению рН раствора, что, в свою очередь, окажет существенное влияние на полноту протекания реакции.
Все это показывает, что при проведении анализа процессу гидролиза необходимо уделять серьезное внимание.
|
|
|
Растворы, способные сохранять практически постоянное значение рН при разбавлении, при добавлении небольшого количества сильных кислот или щелочей, называют буферными растворами, или буферными смесями.
К таким растворам относят смеси сопряженных кислот и оснований. Например:
| CH3COOH кислота | + | CH3COONa сопряженное основание |
| NH4OH основание | + | NH4Cl сопряженная кислота |
Буферными свойствами обладают смеси, состоящие:
- из слабой кислоты и ее соли (ацетатный, формиатный, бензоатный буферные растворы);
- из слабого основания и его соли (аммонийный буферный раствор);
- из кислых солей с различной замещенностью водорода металлом (фосфатный буфер). В фосфатном буферном растворе NaH2PO4 играет роль слабой кислоты, Na2HPO4 – сопряженного основания (соль слабой кислоты);
- из слабой многоосновной кислоты и кислой соли этой кислоты (сопряженное основание), например: H3PO4 +KH2PO4;
- из кислой соли (кислоты) и средней соли (сопряженного основания), например: NaHCO3 + Na2CO3, и т. д.
Варьируя концентрацию кислоты и сопряженного с ней основания, удается получить буферные растворы с заданным значением рН.
При проведении аналитических операций иногда возникает необходимость поддерживать в исследуемом растворе определенное значение рН среды. С этой целью используют различные буферные системы, способные поддерживать постоянное значение рН.
|
|
|
Сущность буферного действия заключается в том, что одно из соединений, входящих в состав буферной системы, сможет связывать ионы водорода, а другое – гидроксид-ионы в малодиссоциируемые соединения. Если к ацетатному буферному раствору (CH3COOH+CH3COONa) прибавить небольшое количество NaOH, то последний нейтрализуется избытком CH3COOH, образуя H2O. Вместо израсходованных Н + - ионов уксусная кислота, диссоциируя, дает новые. В результате рН раствора изменяется незначительно.
Когда к ацетатному буферному раствору добавляется небольшое количество сильной кислоты, анионы CH3COO-, соединяясь с ионами Н+ сильной кислоты, образуют молекулы слабо диссоциирующей CH3COOH. Таким образом, сильная кислота заменяется слабой уксусной, и концентрация Н+ изменяется мало.
Рассмотрим вывод расчетной формулы рН буферной смеси на примере смеси, состоящей из слабой кислоты и сопряженного основания (соли слабой кислоты), используя З.Д.М. и учитывая влияние сопряженного основания.
Диссоциация соли:
MeAn  Me+ + An-
Me+ + An-
| C соли | C соли | C соли |
Диссоциация слабой кислоты в присутствии соли слабой кислоты:
|
|
|
HAn  H+ + An-
H+ + An-
Общая равновесная концентрация An- будет складываться из концентрации An- за счет диссоциации кислоты, которую обозначим, и концентрации An- за счет диссоциации соли cсоли.
Примем x << cсоли и x << cкисл, тогда выражение для константы диссоциации слабой кислоты примет следующий вид:
 ;
; 
 ;
;  (5.1.1)
(5.1.1)
Для буферной системы, состоящей из слабого основания и сопряженной кислоты (соли слабого основания), используя те же рассуждения, можно получить следующее выражение для расчета рН:

Пример.
Вычислить рН раствора, полученного путем смешения 10мл 0,2 М раствора пропионовой кислоты и 70мл 2,0 М раствора пропионата.
Решение.
При смешении раствора произошло разбавление, концентрация компонентов буферного раствора изменилась:
 ;
;  ;
;

Количественной величиной, характеризующей способность буферных растворов поддерживать постоянное значение рН при добавлении к ним сильных кислот и щелочей является, буферная емкость (β).
Количество молей сильной кислоты или щелочи, прибавление которых к одному литру буферного раствора изменяет его рН на единицу, называется буферной емкостью (β):

Максимальная буферная емкость обычно наблюдается у тех растворов, которые содержат равные концентрации слабой кислоты и ее соли, слабого основания и его соли. Буферная емкость тем больше, чем выше концентрация компонентов буферной смеси.
|
|
|
Пример.
Определить, как изменится рН аммиачной буферной смеси с концентрацией основания cосн = 0,1 М и cсоли = 0,1 М при введении в нее:
- 0,01 М HCl;
- 0,05 М HCl.
Решение.
Значение рН исходной буферной смеси определяется по формуле

При введении в буферный раствор 0,01 М HCl (случай а) концен-трация NH 4OH уменьшится за счет реакции нейтрализации NH 4OH и HCl; сосн = 0,10 - 0,01 = 0,09 М, а концентрация соли NH 4Cl возрастет; ссоли = 0,10 + 0,01 = 0,11 М:

ΔрН = 9,24 - 9,15 = 0,09,
т. е. значение рН от введения 0,01 М HCl практически не изменится.
Аналогично рассуждая (случай б), получим:
сосн = 0,10 - 0,05 = 0,05 М; ссоли = 0,10+0,05 = 0,15 М;
 ;
;
ΔрН = 9,24 - 8,77 = 0,47.
Введение 0,05 М HCl привело к изменению рН буферного раствора на 0,5 единицы.
Буферные системы играют большую роль не только в химии. В животных и растительных организмах также действуют сложные буферные смеси, поддерживающие постоянным рН крови, лимфы и других жидкостей. Буферными свойствами обладает и почва, которой свойственно противодействовать внешним факторам, изменяющим рН почвенного раствора.
Реакции окисления-восстановления – это реакции, связанные с переходом электронов от одного атома (или иона) – восстановителя к другому атому (или иону) – окислителю. Процесс отдачи электронов называют окислением, присоединение их другим веществам – восстановлением.
При окислении степень окисления повышается, при восстановлении – понижается. Окислительно-восстановительную реакцию можно разделить на полуреакцию окисления и полуреакцию восстановления.
Например, реакцию
SnCl2 + 2FeCl3 = SnCl4 + 2FeCl2
можно представить в виде суммы полуреакций:
 (окисление)
(окисление)
 (восстановление)
(восстановление)
Вещества, входящие в полуреакцию, образуют окислительно-восстановительную пару, или редокс-пару. Один из компонентов этой пары (с высшей степенью окисления) называют окисленной формой, другой (с низшей степенью окисления) – восстановленной формой. Окисленная форма каждой окислительно-восстановительной пары является окислителем, восстановленная – восстановителем.
В результате реакции окисления-восстановления окислитель, например Fe3+, переходит из окисленной формы в восстановленную Fe2+, а восстановитель, например Sn2+, – из восстановленной формы – в окисленную Sn4+. Поэтому если реакция окисления-восстановления обратима, то в растворе всегда будут находиться в равновесии две равновесные окислительно-восстановительные системы. В приведенном выше примере – это система Fe3+/Fe2+ и система Sn4+/Sn2+. Состояние равновесия окислительно-восстановительной реакции характеризуется величиной окислительно-восстановительного потенциала Е, который можно измерить экспериментально или рассчитать по формуле Нернста.
При экспериментальном определении окислительно-восстановительного потенциала различных редокс-пар измеряют электродвижущую силу (ЭДС) гальванического элемента, представляющую собой разность равновесных потенциалов обоих составляющих его полуэлементов. Каждый полуэлемент данного гальванического элемента содержит соответствующую окислительно-восстановительную пару. Значение редокс-потенциала измеряют относительно какой-либо стандартной пары, в качестве которой принята пара  при концентрации Н+ – ионов, равной 1 моль/л, и давлении газообразного водорода, равном 1 атм. Это так называемый стандартный (нормальный) водородный электрод. Его потенциал условно принят равным нулю. При 25° С и концентрациях окисленной и восстановленной форм 1 моль/л результатом измерения ЭДС гальванического элемента является стандартный окислительно-восстановительный потенциал
при концентрации Н+ – ионов, равной 1 моль/л, и давлении газообразного водорода, равном 1 атм. Это так называемый стандартный (нормальный) водородный электрод. Его потенциал условно принят равным нулю. При 25° С и концентрациях окисленной и восстановленной форм 1 моль/л результатом измерения ЭДС гальванического элемента является стандартный окислительно-восстановительный потенциал  , который выражается в вольтах.
, который выражается в вольтах.
Водородный электрод может служить либо катодом, либо анодом, в зависимости от того, какой полуэлемент соединен с ним.
Положительный знак потенциала указывает на то, что окисленная форма измеряемой редокс-пары является более сильным окислителем, чем ион водорода. Отрицательный знак потенциала означает, что вос-становленная форма данной редокс-пары является более сильным восстановителем, чем молекулы Н 2.
Значения стандартных окислительно-восстановительных потенциалов приводятся в справочных таблицах (см. Прил. 3).
По величине стандартных редокс-потенциалов можно судить об окислительной и восстановительной активности входящих в состав пар окислителя и восстановителя.
Чем больше стандартный редокс-потенциал данной пары, тем более сильным окислителем является соответствующая окисленная форма и тем более слабым восстановителем – восстановленная форма. Например,  . Очевидно, что окисленная форма пары
. Очевидно, что окисленная форма пары  , т. е. Н+ – ионы являются более слабыми окислителями, чем Fe3+, а свободный Н2 &nadsh; более энергичным восстановителем, чем Fe2+ – ионы. Так как для пары Zn2+/ Zn E° = -0,76B, то Zn2+ – ионы являются еще более слабым окислителем, а металлический Zn – еще более сильным восстановителем, чем молекулы Н 2, и т. д.
, т. е. Н+ – ионы являются более слабыми окислителями, чем Fe3+, а свободный Н2 &nadsh; более энергичным восстановителем, чем Fe2+ – ионы. Так как для пары Zn2+/ Zn E° = -0,76B, то Zn2+ – ионы являются еще более слабым окислителем, а металлический Zn – еще более сильным восстановителем, чем молекулы Н 2, и т. д.
Реальные, или равновесные, потенциалы процессов окисления-восстановления могут значительно отличаться от стандартных.
Зависимость равновесных потенциалов от природы реагирующих веществ (учитывается через  ), их концентрации, температуры и других факторов описывается уравнением Нернста
), их концентрации, температуры и других факторов описывается уравнением Нернста
 (6.1)
(6.1)
где Е – реальный (равновесный) окислительно-восстановительный потенциал данной пары, В;
 – стандартный окислительно-восстановительный потенциал, В;
– стандартный окислительно-восстановительный потенциал, В;
а ок и а вос – активности окисленной и восстановленной форм, моль/л;
R – универсальная газовая постоянная, равная 8,314 Дж/К.моль;
Т – абсолютная температура, К;
F – число Фарадея, равное 96500 Кл/моль;
z – число электронов, участвующих в полуреакции;
а и в – стехиометрические коэффициенты.
Для разбавленных растворов активности могут быть заменены на равновесные концентрации. После подстановки числовых значений констант и перевода натуральных логарифмов в десятичные уравнение (6.1.1) (для 25°С) принимает вид
 (6.2)
(6.2)
Если в полуреакции участвуют ионы водорода, то их концентрация входит в уравнение Нернста
 (6.3)
(6.3)
где d – стехиометрический коэффициент, стоящий перед Н+ – ионами в полуреакции.
Например, для полуреакции

уравнение Нернста имеет вид

В случае пар, где один из компонентов представляет собой практически нерастворимое в воде вещество, газ или малодиссоциируемое соединение, концентрация его является величиной постоянной, т. е. входит в величину  , и потому не учитывается в уравнении Нернста.
, и потому не учитывается в уравнении Нернста.
Например, для полуреакции 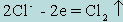 уравнение Нернста имеет вид
уравнение Нернста имеет вид
 ;
;
для полуреакции  уравнение Нернста имеет вид
уравнение Нернста имеет вид
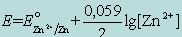 ;
;
для полуреакции H2O2 + 2H+ +2e = 2H2O уравнение Нернста имеет вид

На значение окислительно-восстановительного потенциала влияют концентрация компонентов редокс-пары, рН раствора, присутствие в растворе комплексообразователей и т. д. Влияние всех возможных факторов на величину потенциала раствора следует учитывать при выполнении точных теоретических расчетов или когда влияние различных факторов проявляется в соизмеримой степени.
Пример.
Вычислить значение потенциала системы
MnO-4 + 8H+ + 5e = Mn2+ + 4H20 при pH 1 и pH 5
[MnO-4] = [Mn2+] = 1 моль/л
Решение.

При рН 1 
При рН 5 
Качественное определение направления протекания окислительно-восстановительных процессов заключается в сравнении значений стандартных окислительно-восстановительных потенциалов различных редокс-пар. При этом исходят из следующих положений:
- тандартные окислительно-восстановительные потенциалы являются количественной характеристикой как процесса восстановления, так и обратного ему процесса – окисления;
- окисленная форма редокс-пары с большим значением
 играет роль окислителя по отношению к восстановленной форме пары с меньшим значением
играет роль окислителя по отношению к восстановленной форме пары с меньшим значением  ;
; - чем больше
 , тем более четко выражена окислительная способность системы и тем меньше – ее восстановительная способность;
, тем более четко выражена окислительная способность системы и тем меньше – ее восстановительная способность; - окислительно-восстановительная реакция будет протекать в прямом направлении только в том случае, если электродвижущая сила реакции (ЭДС), вычисляемая как
 , имеет положительное значение, причем чем больше ЭДС, тем интенсивнее протекает реакция;
, имеет положительное значение, причем чем больше ЭДС, тем интенсивнее протекает реакция; - окислительно-восстановительные процессы идут в направлении образования более слабых окислителей и восстановителей.
Пример 1.
Определить, в каком направлении и с какой интенсивностью пойдут следующие реакции:
- Fe2+ + Fe2
 Fe3+ + 2F-
Fe3+ + 2F- - Fe2+ + Cl2
 Fe3+ + 2Cl-
Fe3+ + 2Cl- - Fe2+ + Br2
 Fe3+ + 2Br-
Fe3+ + 2Br- - Fe2+ + I2
 Fe3+ + 2I-
Fe3+ + 2I-
Решение.
По сопоставлению значений  окислительно-восстановительных полуреакций
окислительно-восстановительных полуреакций  ;
;  ;
;  ;
;  ;
;  видно, что окислить Fe 2+– ионы до Fe 3+ можно действием F2, Cl2 и Br2.
видно, что окислить Fe 2+– ионы до Fe 3+ можно действием F2, Cl2 и Br2.
Вычислим ЭДС реакций:
- 2,77 - 0,77= 2,00 В;
- 1,36 - 0,77= 0,59 В;
- 1,08 - 0,77 = 0,31 В.
Наиболее сильно выражена окислительная способность у молекул F2, менее всего – у Br2. Ионы Fe2+ нельзя окислить действием I2: ЭДС = 0,54 - 0,77= - 0,23 В. Реакция будет протекать в направлении восстановления ионов Fe3+ иодид-ионами:

Пример 2.
Определить, какая реакция будет протекать, если на раствор SnCl4 подействовать металлическим железом:
 ;
; 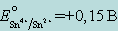 ;
; 
Решение.
ЭДС реакций:
- 0,15 - (-0,44) = +0,59;
- 0,01 - (-0,44) = +0,45 В.
Так как в первую очередь протекает тот процесс, которому соответствует наибольшая разность стандартных редокс-потенциалов, пойдет реакция восстановления Sn4+ до Sn 2+:

Изменяя концентрации отдельных компонентов каких-либо окислительно-восстановительных пар, можно значительно изменять и их потенциалы. При этом направление реакции между такими парами станет обратным тому, которое ожидается на основании их стандартных потенциалов.
Например, в титриметрическом анализе медь определяют иодометрическим методом, основанном на реакции

В этой реакции участвуют пары Cu2+/Cu+ ( =+0,15 В) и I2/2I- (
=+0,15 В) и I2/2I- ( = +0,54 В). Судя по величине стандартных потенциалов, следовало бы ожидать, что реакция должна протекать справа налево, т. к. йод – более сильный окислитель, чем ионы меди. Однако, вследствие малой растворимости образующегося осадка CuI (SCuI = 10-6 моль/л), сильно понижается концентрация Cu+-ионов. При этом наблюдается значительное повышение потенциала системы (см. Тема 6,уравнение (6.2)) до величины
= +0,54 В). Судя по величине стандартных потенциалов, следовало бы ожидать, что реакция должна протекать справа налево, т. к. йод – более сильный окислитель, чем ионы меди. Однако, вследствие малой растворимости образующегося осадка CuI (SCuI = 10-6 моль/л), сильно понижается концентрация Cu+-ионов. При этом наблюдается значительное повышение потенциала системы (см. Тема 6,уравнение (6.2)) до величины  , превышающей потенциал системы I2/2I-. Вследствие этого реакция взаимодействия Cu2+-ионов с I--ионами протекает практически до конца слева направо.
, превышающей потенциал системы I2/2I-. Вследствие этого реакция взаимодействия Cu2+-ионов с I--ионами протекает практически до конца слева направо.
Причиной изменения направления реакции может являться не только понижение концентрации того или иного иона в растворе в результате образования малорастворимого соединения, но и связывания этого иона в достаточно прочный комплекс.
Например, реакция выделения свободного йода, при действии на раствор йодида раствором соли железа (3+),
2Fe3+ + 2I-  2Fe2+ + I2
2Fe2+ + I2
протекать не будет, если в раствор внести F--ионы, которые связывают Fe3+ в комплексный ион [FeF6]3- и тем самым понижают в растворе концентрацию окисленной формы в паре Fe3+/Fe2+.
Изменение направления окислительно-восстановительного процесса может быть иногда следствием изменения рН среды.
Так, судя по величинам стандартных потенциалов пар H3AsO4 / HAs02 ( =+0,56 В) и I2/2I- (
=+0,56 В) и I2/2I- ( = + 0,54 В), между ними должна протекать реакция
= + 0,54 В), между ними должна протекать реакция
H3AsO4 + 2I- + 2H+ = HAs02 + I2 + 2H2O
Если же реакцию ведут в присутствии избытка NaHCO3, который поддерживает рН раствора равным ~8, окислительно-восстановительный потенциал системы H3AsO4 + 2H+/ HAs02 + H2O понизится до величины  = - 0,136 В. В этих условиях йод будет окислять HAsO2 до H3AsO4:
= - 0,136 В. В этих условиях йод будет окислять HAsO2 до H3AsO4:

Следует заметить, что с возможностью изменения направления реакции на противоположное приходится считаться тогда, когда соответствующие пары имеют близкие по величине стандартные потенциалы.
Количественной характеристикой направления и полноты проте-кания процесса является константа равновесия окислительно-восстановительной реакции.
В некоторых случаях необходимо знать не только направление окислительно-восстановительной реакции, но и насколько полно она протекает. Так, например, в количественном анализе можно использовать лишь те реакции, которые практически протекают на 100 % (или приближаются к этому).
Степень протекания реакции слева направо определяется константой равновесия. Для реакции
Zn + CuSo4 = Cu + ZnSo4 или Zn + Cu2+  Zn2+ + Cu
Zn2+ + Cu
согласно закону действия масс, можно записать

где K – константа равновесия.
Константу равновесия нетрудно рассчитать, зная стандартные потенциалы обеих окислительно-восстановительных пар Zn2+/Zn и Cu2+/Cu. В уравнение (6.2)(см.Тема 6)подставим значения  соответствующих редокс-пар и получим:
соответствующих редокс-пар и получим:
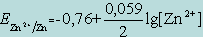 ;
;
 .
.
При равновесии E Zn2+/Zn = E Cu2+/Cu, тогда
 =
= 
или 

или 
Константа равновесия показывает, что цинк вытесняет из CuSO4 ионы меди до тех пор, пока в растворе концентрация ионов Cu2+ не станет в  раз меньше, чем концентрация ионов Zn 2+. Это значит, что рассматриваемая реакция практически идет до конца.
раз меньше, чем концентрация ионов Zn 2+. Это значит, что рассматриваемая реакция практически идет до конца.
Константа равновесия для любого обратимого окислительно-восстановительного процесса выражается следующей формулой:
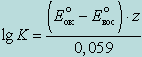 , (7.1)
, (7.1)
где K – константа равновесия реакции;
 и
и  – стандартные потенциалы окислителя и восстановителя;
– стандартные потенциалы окислителя и восстановителя;
z – количество электронов, равное наименьшему кратному из числа электронов, отданных восстановителем и принятых окислителем.
Из формулы (7.1) видно, что константа равновесия должна быть тем больше, чем больше разность стандартных потенциалов обеих пар. Если эта разность достаточно велика, т. е. 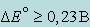 , реакция идет практически до конца. Наоборот, при малой разности потенциалов химическое превращение взаимодействующих веществ до конца не пойдет, если не создать условий, которые будут способствовать смещению равновесия в нужном направлении. Так, в случае реакции
, реакция идет практически до конца. Наоборот, при малой разности потенциалов химическое превращение взаимодействующих веществ до конца не пойдет, если не создать условий, которые будут способствовать смещению равновесия в нужном направлении. Так, в случае реакции
H3AsO4 + 2I- + 2H+ = HAsO2 + I2 + 2H2O,
константа равновесия которой (соответственно разности стандартных потенциалов ~ 0,02 В) равна всего ~ 10, для достижения практически полного протекания окислительно-восстановительного процесса необходимо увеличить концентрацию H+-ионов прибавлением к раствору концентрированной соляной кислоты.
Следует заметить, что на основании величин стандартных потенциалов нельзя сделать заключение о скорости установления равновесия, т. к. иногда большей разности стандартных потенциалов отвечает меньшая скорость реакции. Например, реакция окисления водорода кислородом, разность стандартных потенциалов которой 1,23 В, протекает при комнатной температуре с неизмеримо малой скоростью. Наоборот, реакция окисления кислородом Fe2+- ионов до ионов Fe3+ идет гораздо быстрее, хотя разность стандартных потенциалов в этом случае значительно меньше (~0,46 В). Факторами, ускоряющими медленно протекающие реакции, являются температура, концентрация, катализаторы и т. д.
Пример.
Исходя из константы равновесия, предсказать вероятность окисления CuS и HgS азотной кислотой:
- 3CuS + 8HNO3= 3S + 3Cu(NO3)2 + 2NO + 4H2O
E ºHg2++S/CuS=+0,60B; E ºNO3- +4H+/NO+2H2O=+0,96B - 3HgS + 8HNO3 = 3S + 3Hg(NO3)2 + 2NO + 4H20
E ºHg2++S/HgS=+1,04B; E ºNO3- +4H+/NO+2H2O=+0,96B
Решение.
Находим константу равновесия реакции согласно уравнению (7.1):
a)  , откуда K = 1036
, откуда K = 1036
Большая величина константы показывает, что равновесие этой реакции практически полностью сдвинуто вправо, следовательно, CuS хорошо растворяется в азотной кислоте;
б)  , откуда K = 10-8
, откуда K = 10-8
Малая величина константы означает, что равновесие этой реакции практически полностью сдвинуто влево, т. е. HgS в противоположность сульфиду меди практически нерастворим в азотной кислоте.
Дата добавления: 2016-01-04; просмотров: 714; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

