Гидролиз соли, образованной слабой многоосновной кислотой или слабым многоосновным основанием
В данном случае гидролиз будет проходить ступенчато. Рассмотрим гидролиз соли, образованной сильным основанием и слабой многоосновной кислотой, на примере гидролиза карбоната натрия.
Пример.
Вычислить рН раствора 0,1 М раствора Na2CO3.
Решение.
1 ступень гидролиза:
H2O  H+ + OH- KH2O
H+ + OH- KH2O
CO2-3 + H+  HCO-3 1/K2
HCO-3 1/K2
CO2-3 + H2O  HCO-3 + OH-
HCO-3 + OH-

2 ступень гидролиза:
H2O  H+ +OH- K H2O
H+ +OH- K H2O
HCO-3+ H+  H2CO3 1/K1
H2CO3 1/K1
HCO-3 + H2O  H2CO3 + OH-
H2CO3 + OH-

Из приведенных уравнений видно, что т. к. K2<< K1, то K'гидр >> то K"гидр, т. е. гидролиз сильнее происходит по первой ступени. Поэтому при расчете рН раствора таких солей пренебрегают количеством ионов ОН-, образовавшихся по второй ступени, по сравнению с их количеством, образованным по первой ступени гидролиза. Расчет ведут по формуле
 (4.4.1)
(4.4.1)
где K2 – константа диссоциации H2CO3 по последней ступени.
В данном случае K2 = 10,32 и
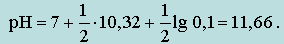
Дата добавления: 2016-01-04; просмотров: 30; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
