Растворимость осадков. Связь растворимости с произведением растворимости
Растворимость (S) – это концентрация вещества в его насыщенном растворе. Величина S выражается в молях растворенного вещества в 1л раствора (моль/л) или реже в граммах растворенного вещества в 100 мл раствора.
Произведение растворимости малорастворимого соединения MenAnm связано с его растворимостью простым соотношением, которое получается из следующих соображений. Если в насыщенном растворе соединения Men Anm растворимость составляет S моль/л, то концентрация ионов в насыщенном растворе будет равна
[Me] = nS и [An] = mS
так как
MenAnm  n Me + m An
n Me + m An
nS mS
Подставляя эти значения в выражение произведения растворимости, получим
KS(Men Anm)= [Me]n[An]m = [ nS ]n [ ms ]m = n n· m m Sn+m (8.5)
Из уравнения (8.5) следует
 (8.6)
(8.6)
Соотношение (7.5) и (7.6) позволяет рассчитывать KS по растворимости и, наоборот, рассчитывать растворимость, если известно KS.
Например, для Ag2C2O4 можно вычислить растворимость следующим образом:
Ag2C2O4  2Ag+C2O4-2
2Ag+C2O4-2
2S S
KS(Ag2C2O4)= 3,5·10-11
KS(Ag2C2O4)=[Ag+]2 [C2O42-]=(2S)2·S = 4S3
или, воспользовавшись формулой (8.6),

Зная растворимость, легко вычислить произведение растворимости.
Пример.
Растворимость сульфата кальция при 20º С равна 2 г/л. Вычислить KºS(CaSO4).
Решение.
Сначала вычисляют молярную концентрацию насыщенного раствора CaSO4:
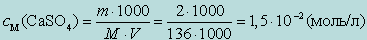
Следовательно, концентрация [Ca2+] = [SO2-4]= 1,5 ·10-2 моль/л Далее вычисляют ионную силу раствора I и коэффициенты активности для Ca2+ и SO2-4 по уравнениям (2.1.2) и (2.1.4)





Дата добавления: 2016-01-04; просмотров: 72; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
