Растворы гидролизующихся солей. Расчет pН
Гидролизом солей называют взаимодействие солей с водой, сопровождающееся образованием малодиссоциирующих соединений и изменением рН раствора.
Возможны три случая гидролиза солей.
- Гидролиз солей, образованных сильным основанием и слабой кислотой (гидролиз по аниону):
CH3COONa + H2O  CH3COOH + NaOH CH3COO- + H2O
CH3COOH + NaOH CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
В растворе в результате гидролиза накапливаются OH--ионы. Раствор приобретает щелочную среду (рН>7).
- Гидролиз солей, образованных сильной кислотой и слабым основанием (гидролиз по катиону):
NH4Cl +H2O  NH4OH + HCl
NH4OH + HCl
NH+4 +H2O  NH4OH +H+
NH4OH +H+
В растворе в результате гидролиза накапливаются [H+], раствор приобретает кислую среду (рН<7).
- Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по катиону и аниону):
CH3COONH4 + H2O  CH3COOH + NH4OH
CH3COOH + NH4OH
Если соль образована сильным основанием и сильной кислотой, например: NaCl, KCl, NaNO3, KNO3, K2SO4, Na2SO4 и др., то гидролиз не происходит и рН раствора равен 7.
Количественной характеристикой гидролиза служат константа гидролиза Kгидр и степень гидролиза h.
Под степенью гидролиза h понимают отношение концентрации гидролизованной соли к ее общей концентрации в растворе:
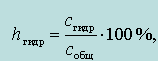
где cгидр – общее число молей гидролизованной соли;
cобщ – общее число молей растворенной соли.
Рассмотрим процесс гидролиза соли с учетом протолитических равновесий на примере гидролиза соли по аниону:
H2O  H+ + OH- KH2O
H+ + OH- KH2O
An- + H+  HAn 1/Kкисл
HAn 1/Kкисл
An- +H2O  HAn + OH-
HAn + OH- 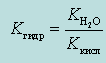
| C | C соли | ||
| [ ] | C соли - x | x | x |
cсоли – концентрация соли, моль/л.
|
|
|
На основании З.Д.М. запишем:
 (4.1.1)
(4.1.1)
Так как x << cсоли, получим
 (4.1.2)
(4.1.2)
Зная, что концентрация  и подставляя в это выражение значение [OH-] из (4.1.2), получим следующее уравнение:
и подставляя в это выражение значение [OH-] из (4.1.2), получим следующее уравнение:

После математических преобразований выражение для расчета рН раствора соли, образованной слабой кислотой и сильным основанием, примет вид
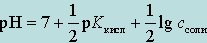 (4.1.3)
(4.1.3)
Степень гидролиза будет равна
 (4.1.4)
(4.1.4)
Используя указанный в данном примере подход, можно вывести формулы для расчета K гидр, h, рН для случая гидролиза соли по катиону, а также по катиону и аниону одновременно.
Дата добавления: 2016-01-04; просмотров: 32; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
