Методы титриметрического анализа
| Метод | Протекающая реакция | Титрант |
| Кислотно-основное титрование | Н++ОН-→ Н2О | HCl, KOH |
| Окислительно-восстановительное титрование | Oкс.1+Вост.1→ Вост.2+Окс.2 | KMnO4, I2, Na2S2O3, K2Cr2O7 |
| Осадительное титрование | Men++ Anm-→ MemAnn↓ | AgNO3, Hg2(NO3)2 |
| Комплексонометрическое титрование | Men+ +YNa2H2→ →[YMe]-4+n +2Na++2H+ | YNa2H2 |
Определить точку эквивалентности можно визуально (индикаторный способ) или инструментально (наблюдая, например, за изменением потенциала электрода или силой тока). Для того чтобы представить процесс титрования, необходимо изучить теорию метода и проследить за всеми происходящими изменениями при добавлении титранта к анализируемому веществу. Удобнее это сделать при построении кривой титрования, которая графически выражает зависимость изменения свойства системы (рН, Е, рМе) от объема добавляемого титранта. При этом следует выделить четыре основных этапа титрования:
- в начале титрования;
- до точки эквивалентности;
- в точке эквивалентности;
- после точки эквивалентности.
На любой кривой титрования имеются области плавного (до и после точки эквивалентности) и резкого (вблизи точки эквивалентности) изменения рассчитываемого параметра. Резкое изменение называется скачком титрования, границы скачка устанавливаются с точностью ± 0,1 %. Момент, при котором заканчивается титрование с выбранным индикатором, называют конечной точкой титрования. Даже при правильно выбранном индикаторе теоретически рассчитанная точка эквивалентности не совпадает с практически установленной конечной точкой титрования. Это приводит к возникновению индикаторной ошибки.
|
|
|
Индикаторы
Для фиксирования точки эквивалентности в титриметрическом методе используют индикаторы: в кислотно-основном методе – рН - индикаторы, в окислительно-восстановительном методе – редокс-индикаторы, в комплексонометрии – металл-индикаторы. Кроме того, в титриметрии пользуются безиндикаторным способом фиксирования точки эквивалентности, например, методе пермангонатометрии в качестве титранта используют окрашенный раствор MnO4-, который при восстановлении обесцвечивается и переходит в Mn2+, в точке эквивалентности одна лишняя капля титранта окрашивает раствор в бледно-розовый цвет. В методе иодометрии применяют специфический индикатор – крахмал.
Индикаторы кислотно-основного метода. Кислотно-основные индикаторы или рН-индикаторы представляют собой органические вещества – слабые электролиты, обладающие кислотными или основными свойствами:
| Hind | ↔ | H+ + Ind- |
| кислота | основание | |
| Молекулярная или кислотная форма индикатора | Ионная или основная форма индикатора |
|
|
|
Окраска кислотных форм индикатора отличается от окраски основных форм, поэтому рН-индикаторы меняют свою окраску при действии кислот и оснований. Для того, чтобы правильно выбрать индикатор, в каждом конкретном случае необходимо рассмотреть причины изменения окраски индикатора в зависимости от изменения рН раствора. Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение рН-индикаторов в кислых и щелочных средах.
Ионная теория индикаторов. Окраска раствора, в котором индикатор находится в кислотной форме [Hind], отличается от окраски раствора, в котором индикатор находится в ионной форме [Ind-]. Если равновесие реакции смещается вправо, то в растворе преобладает окраска, характерная для ионной формы индикатора. а если равновесие смещено влево, то в растворе преобладает окраска, характерная для молекулярной формы индикатора. При определенном соотношении концентраций молекулярной и ионной форм индикатора раствор может иметь промежуточную – переходную окраску. Так, например, метиловый оранжевый в сильно кислотой среде имеет красную окраску, а в щелочной – желтую. Смешение красного и жёлтого цветов приводит к появлению промежуточной оранжево-красной окраски.
|
|
|
Таким образом, согласно ионной теории индикаторов, предложенной Освальдом, все цветные индикаторы, применяемые в методе кислотно-основного титрования, являются слабыми органическими кислотами и основаниями, а их окраска связана с концентрациями ионов Н+ или ОН-. Для рН- индикаторов константа ионизации выражается формулой:
 (7)
(7)
Константа ионизации индикатора Кинд – величина постоянная, поэтому добавление в раствор кислоты или щелочи приводит к уменьшению или увеличению [Ind-]. Таким образом, переход одной окраски, присущей молекулярной форме кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием [Н+] или [ОН-], т.е. зависит от рН раствора.
Хромофорная теория индикаторов. Поведение индикаторов, объясняемое ионной теорией, дополняется хромофорной теорией индикаторов, согласно которой изменение окраски индикаторов связано с изменением структуры их молекул, вызываемым действием [Н+] или [ОН-].
По хромофорной теории в процессе изменения рН раствора меняется строение молекул кислотно-основных индикаторов. Это явление обуславливается бензоидно-хиноидной таутомерией. Простейшим примером бензоидно-хиноидной таутомерии является таутомерия моноксима хинона, который по составу тождественен нитрозофенолу:
|
|
|

Обе формы представляют собой одно и то же химическое соединение в различных таутомерных формах. В растворе хиноксима устанавливается подвижное химическое равновесие между обеими таутомерными формами, зависящее от различных факторов. Подобные таутомерные превращения происходят и в растворах индикаторов.
Цветность органических соединений, согласно хромофорной теории, обуславливается присутствием в них атомных группировок, так называемых хромофорных групп:

В состав индикаторов могут входить группы атомов, которые не вызывают окраски, но могут усиливать появляющуюся окраску. Такие группы атомов получили название ауксохромов (-ОН, -NH2, -NHR). Таким образом, изменение окраски индикатора происходит в том случае, когда появляются или исчезают хромофорные группы и когда вместо хромофорных группы появляются другие. Если хромофорные группы превращаются в нехромофорные – окраска исчезает.
Ионно-хромофорная теория индикаторов. В процессе развития науки ионная и хромофорная теория были объединены в единую ионно-хромофорную теорию индикаторов. Согласно ионно-хромофорной теории индикаторов, происходящее вследствие последовательного присоединения органическими соединениями иона Н+ при действии кислоты или отнятия ионов Н+ при действии щелочи связано со смещением ионных равновесий индикаторов, сопровождающихся одновременным изменением их структуры.

Для рН-индикаторов наиболее характерными факторами, вызывающими изменение окраски, являются соотношения количеств молекулярной и ионной форм индикатора, происходящее под влиянием кислот и щелочей, и появление или исчезновение хромофорных групп или превращений иных хромофорных групп в другие. Для фиксирования момента эквивалентности в методе кислотно-основного титрования часто используют фенолфталеин и метиловый оранжевый. Индикаторные свойства метилового оранжевого обусловлены таутомерией между бензоидной и хиноидной формами. Необходимо отметить, что в то время как равновесие ионизации индикаторов устанавливается практически мгновенно, процесс таутомерного превращения протекает во времени, поэтому изменение окраски индикатора протекает не всегда быстро.
Интервал перехода окраски индикатора. Изменение окраски кислотно-основных индикаторов происходит вследствие добавления к раствору кислоты или щёлочи. Связь между окраской индикатора и величиной рН раствора можно установить, исходя из ионно-хромофорной теории индикаторов.
| Hindо | ↔ | Hind | ↔ | H+ + Ind- |
| Одна таутомерная форма | I | Другая таутомерная форма | II | Щелочная среда |
| Кислая среда |
Для равновесия (I) 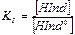 ; (8)
; (8)
Для равновесия (II)  ; (9)
; (9)
 (10)
(10)
Произведём преобразования и получаем:
 или
или  (11)
(11)
Величина Кинд называется кажущейся константой ионизации индикатора. Проведем преобразования относительно [H+]:
 (12)
(12)
 (13)
(13)
 (14)
(14)
Уравнение (14) является основным уравнением теории индикаторов и выражает зависимость между окраской индикатора и величиной рН.
Глаз человека улавливает изменение окраски в случае, если концентрация одной формы приблизительно в 10 раз меньше концентрации другой:
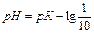 или
или  , тогда
, тогда
 (15)
(15)
Окраска любого индикатора изменяется только при определенных значениях рН, т.е. внутри определенного интервала значений рН, называемого интервалом перехода окраски рН-индикатора.
индикаторы окислительно-восстановительного титрования. Для фиксирования точки эквивалентности в окислительно-восстановительном методе применяют редокс-индикаторы – вещества, способные обратимо окисляться и восстанавливаться при достижении раствором определенного значения потенциала, причем окислительная и восстановительная формы имеют различную окраску.
| Indокс.+пе | ↔ | Indвосст. |
Известно, что система, состоящая из окисленной и восстановленной форм, представляет собой окислительно-восстановительную пару, и к ней, следовательно, может быть применено уравнение Нернста:
 (16)
(16)
Когда потенциал раствора становится равным стандартному потенциалу, индикатор окрашивает раствор в свой промежуточный цвет, поскольку в этот момент концентрация обеих форм будет одинаковой. При более высоких значениях потенциала индикатор постепенно переходит в окисленную форму, а при более низких – в восстановленную форму. Как и в случае с кислотно-основными индикаторами, человеческий глаз начинает замечать изменение окраски индикатора при соотношении концентраций обеих форм, равном 1:10. Таким образом, область перехода окраски редокс-индикаторов – промежуток значений потенциалов, в пределах которого индикаторы видимо для нашего глаза меняют свою окраску:
 (17)
(17)
Наиболее часто применяют редокс-индикаторы: дифениламин, фенилантраниловая кислота.

Дата добавления: 2016-01-04; просмотров: 86; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
