Первичные и вторичные стандарты
Для работы в титриметрическом анализе используют стандартные растворы, то есть растворы с точно известной концентрацией. Различают первичные и вторичные стандарты. Первичным стандартом является вещество, которое можно использовать для определения точной концентрации титранта. Растворы первичных стандартов готовят путем растворения взятой навески на аналитических весах в определенном объеме воды (в мерной колбе). К веществам, которые используются для приготовления первичных стандартов (установочное вещество), предъявляют ряд требований. Если вещество можно получить в химически чистом виде, оно устойчиво при хранении, сравнительно хорошо растворимо и если состав его строго соответствует определенной формуле, то точную концентрацию определяют по точной навеске. Кроме того, это вещество должно иметь, возможно, большую массу эквивалента. К таким веществам относятся, например, тетраборат натрия Na2B4O7∙10H2O, карбонат натрия Na2CO3, щавелевая кислота H2C2O4∙2H2O, дихромат калия K2Cr2O7, хлорид натрия NaCl. Концентрация таких растворов рассчитывается по формуле:
 ,
,  (18)
(18)
Титр Т – отношение количества граммов вещества, растворенных в 1 мл раствора. Растворы вторичных стандартов (титрантов, рабочих растворов) готовятся приблизительной концентрации, которую точно устанавливают путем титрования ими растворов первичных стандартов, то есть проводят стандартизацию. Объем раствора точно известной концентрации отбирают пипеткой, помещают в коническую колбу для титрования, титрант помещают в бюретку. Объем титранта, пошедший на реакцию с определяемым веществом, фиксируют по бюретки, концентрацию титранта рассчитывают по формуле:
|
|
|
 (19)
(19)
Прежде, чем приступать к выполнению лабораторных работ по титриметрическому анализу, необходимо научиться проводить расчёты для приготовления и разбавления растворов, перехода от одних способов выражения концентрации к другим. Важной характеристикой любого раствора является концентрация. Под концентрацией раствора понимают количество вещества, растворенного в единице объема или массы раствора.
Рассмотрим способы выражения концентраций. Молярная концентрация с – отношение числа молей растворённого вещества в 1 л раствора:
 ,
,  (20)
(20)
Эквивалентом называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-нибудь другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. Подобный смысл вкладывается в термин «эквивалент» в случае реакций ионного обмена и в электрохимических методах анализа. При использовании термина «эквивалент» всегда необходимо указывать, к какой конкретной реакции он относится. На практике удобнее пользоваться понятием фактор эквивалентности. Фактор эквивалентности fэкв – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. fэк в – безразмерная величина, причем  .
.
|
|
|
Молярная концентрация эквивалентов с – отношение числа моль-эквивалентов растворенного вещества в 1 л раствора:
 ,
,  (21)
(21)
Часто состав раствора выражают в доле компонента от общего количества вещества. Этот способ выражения состава заключается в независимости от агрегатного состояния анализируемого объекта. Доля означает отношение числа частей компонента к общему числу частей объекта. В зависимости от выбранной единицы различают молярную α, массовую ω, объемную φ доли:
 (22)
(22)
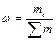 (23)
(23)
 (24)
(24)
Долю выражают в процентах, промиллях (ppt) – число частей на тысячу частей объекта; миллионных долях (ppm); миллиардных долях (ppb). Эти единицы измерения удобны для оценки малых концентраций веществ, при этом молярную α, массовую ω, объемную φ доли следует умножать на 103, 106, 109 для получения удобного целого или близкого к нему числа. Например, 1 ppm соответствует 1∙10-4% или 1 мкг/л.
|
|
|
Таблица 3
Формулы пересчёта концентрации растворов
| Определяемая концентрация | Исходная концентрация | ||
| Массовая концентрация ω,% | Молярная концентрация с, моль/л | Молярная концентрация эквивалентов,  моль/л моль/л
| |
| Массовая концентрация ω,% | 
| 
| 
|
| Молярная концентрация с, моль/л | 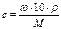
| 
| 
|
Молярная концентрация эквивалентов,  моль/л моль/л
| 
| 
| 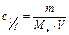
|
Титр, Т 
| 
| 
| 
|
М – молярная масса вещества, г/моль; Мэ – молярная масса эквивалента вещества, г/моль; ρ – плотность раствора, г/мл.
В титриметрии используют три способа титрования: прямое, обратное и титрование заместителя.
В случае прямого титрования анализируемое вещество А взаимодействует с титрантом В, например: aA + bB → продукты реакции,
где a условная единица вещества A реагирует с b условными частицами вещества B. Следовательно, одна частица A эквивалентна (равноценна) 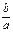 частицам вещества B, т.е.
частицам вещества B, т.е.  , при этом необходимо помнить, что
, при этом необходимо помнить, что  . В точке эквивалентности:
. В точке эквивалентности:

Это важное следствие из закона эквивалентов применяется при всех расчетах в титриметрии. Массу вещества (В), вступившего в реакцию, рассчитываем:
|
|
|
 (25)
(25)
По уравнению реакции
Мэ(А) – Мэ(В)
тА – тВ
откуда:
 (26)
(26)
В том случае, когда для анализа берут не весь раствор анализируемого вещества Vобщ, а только часть его Vа (аликвота), уравнение (25) умножают на  . Если проводится анализ нескольких параллельных проб, удобнее рассчитать титр по определяемому веществу:
. Если проводится анализ нескольких параллельных проб, удобнее рассчитать титр по определяемому веществу:
 (27)
(27)
Титр по определяемому веществу показывает, какое количество г определяемого вещества реагирует с 1 мл титранта. Например,  , показывает, что 1 мл Na2CO3 реагирует с 0,0049 г HCl.
, показывает, что 1 мл Na2CO3 реагирует с 0,0049 г HCl.
Обратное титрование используется в тех случаях, когда реакция между А и В протекает медленно или нет подходящего индикатора для фиксирования точки эквивалентности. В этом случае к А добавляют избыток В и после завершения реакции между ними остаток В оттитровывают D. Количество молей эквивалента определяемого вещества в этом случае равно разности между количеством молей эквивалента веществ B и D:

 (28)
(28)
Титрование заместителя применяют в том случае, когда невозможно провести прямое титрование, так как не соблюдается стехиометричность. В этом случае сначала проводят реакцию определяемого вещества с точно отмеренным объемом вспомогательного реагента, в результате чего получается соединение А' (заместитель), способное реагировать с титрантом В в строго эквивалентном соотношении.
Количество молей эквивалента при титровании заместителя всегда равно количеству молей эквивалента титранта:

Расчет тА осуществляют по формуле (26).
Дата добавления: 2016-01-04; просмотров: 103; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
