Порядок выполнения работы
0,1-0,01 г хлорида железа (III) взвешивают на аналитических весах, помещают в химический стакан вместимостью 50 или 100 мл и добавляют 25 или 50 мл дистиллированной воды и тщательно перемешивают до полного растворения навески. В полученный раствор хлорида железа (III) приливают 15 капель раствора NH4Cl (электролит – коагулянт) и нагревают на песчаной бане до кипения (кипятить раствор нельзя, т.к. хлорид железа летуч при высоких температурах и может быть получен заниженный результат). К нагретому раствору прибавляют по каплям раствор NH3 при постоянном перемешивании стеклянной палочкой до полного осаждения гидроксида железа (этот момент характеризуется исчезновением окраски анализируемого раствора и появлением над ним устойчивого запаха избыточного количества аммиака). Кроме того, после расслаивания фаз проверяют полноту осаждения гидроксида железа. Для этого в прозрачный раствор над осадком прибавляют 2-6 капель раствора NH3, и, если муть не появляется, осаждение считают полным. Добившись полноты осаждения, к раствору с осадком приливают 20-30 мл горячей дистиллированной воды и сразу после расслаивания фаз приступают к фильтрованию декантацией, стараясь не взмучивать осадок и оставлять его в стакане. В данном случае используют фильтр средней плотности (с белой лентой) диаметром 7-9 см, 2-3 раза промывают осадок в стакане с горячей водой однопроцентным раствором NH4NO3 добавляя каждый раз по 4-5 мл его и декантируя. Затем количественно переносят осадок на фильтр, а прилипшие к стенкам стакана частицы снимают с помощью стеклянной палочки и небольшого кусочка беззольного фильтра. На фильтре продолжают промывание осадка до отрицательной реакции вытекающего фильтрата на Cl--ион, присутствие которого в осадке при прокаливании может привести к заниженным результатам, т.к. FeCl3 летуч. Проверка фильтрата на присутствие Cl- ион осуществляется следующим образом. На чистое часовое стекло помещают несколько капель фильтрата, вытекающего из воронки, прибавляют 1 каплю HNO3, препятствующей образованию растворимого комплекса [Ag(NH3)2]Cl, и одну каплю раствора AgNO3. Отсутствие белого осадка или белой мути указывает на то, что операцию промывания можно заканчивать. Влажный фильтр с осадком снимают с воронки, складывают и помещают конусом вверх в предварительно взвешенный фарфоровый тигель. Высушивают, обугливают фильтр и прокаливают осадок до постоянной массы при температуре 800-900оС. После прокаливания до постоянной массы рассчитывают содержание железа в осадке по формуле:
|
|
|
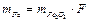

После выполнения гравиметрического анализа студенты приводят в порядок свое рабочее место и сдают химическую посуду и реактивы дежурному учебному мастеру.
|
|
|
Электрогравиметрия
В электрогравиметрическом анализе определяемое вещество выделяют из раствора путем проведения электролиза под действием постоянного электрического тока. Это один из вариантов гравиметрического анализа, в котором в качестве осадителя выступают электроны. Количество выделившегося осадка определяют по массе катода, а в некоторых случаях – анода, до и после электролиза. Осаждаемая и гравиметрическая формы осадка одинаковы – выделенный на электроде металл (или оксид). Осаждаемая форма осадка отличается малой растворимостью, высокой степенью чистоты. Правильно выбранные условия электролиза позволяют предотвратить соосаждение. Осадки на электроде легко промыть, высушить, взвесить. Важной задачей электрогравиметрического анализа является получение чистого, плотного, хорошо сцепленного с электродом осадка. Нежелательно одновременное выделение на электроде металла и водорода, в этом случае получается губчатый осадок.
Электрогравиметрический метод – один из самых точных методов при анализе меди и сплавов на ее основе. Прежде чем приступать к изучению теории метода, необходимо повторить основные законы электролиза – законы Фарадея.
|
|
|
Из законов Фарадея следует, что для выделения одной молярной массы эквивалента любого вещества в процессе электролиза необходимо затратить одно и то же количество электричества, называемое числом Фарадея (F):
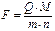 , (3)
, (3)
где Q – количество электричества, равное произведению силы тока I на время его прохождения через раствор (I∙ t), необходимое для выделения на электроде m граммов вещества с молярной массой эквивалента Mэ, равной  (M – молярная масса), n – число электронов, участвующих в реакции.
(M – молярная масса), n – число электронов, участвующих в реакции.
Масса выделившегося вещества:
 (4)
(4)
Формула (4) используется в различных методах, основанных на электролизе, для решения задач, связанных с практическим применением электролиза. Если систему, состоящую из двух электродов и раствора электролита, включить в цепь постоянного тока, то на электродах начинают протекать реакции окисления-восстановления; то есть начинается электролиз, например:
на катоде (-) – восстановление:
| Ni 2+ +2ē → Ni0↓ Zn2+ +2ē → Zn0↓ |
на аноде (+) – окисление:
| H2O → 2H++½O2 +2ē 2Cl- → Cl20 +2e Pb2++2H2O → PbO2+4H++2ē |
На электродах, в первую очередь, окисляются или восстанавливаются те частицы, для электрохимического превращения которых нужна минимальная энергия. По этой причине ионы SO42-, PO43- на аноде не окисляются, так как легче происходит разложение воды.
|
|
|
Для осуществления электролиза требуется большее напряжение, чем необходимо для компенсации противоположно направленного напряжения гальванического элемента, образованного электродами данной системы.
Минимальная величина внешней эдс, при которой в данных условиях начинается электролиз, называется потенциалом разложения:
Еразл = (ЕА - ЕК) + η + IR, (5)
где ЕА - ЕК – эдс обратного элемента, рассчитанная по уравнению Нернста; I – сила тока в A; R – сопротивление всей цепи, Ом; η – перенапряжение.
Перенапряжение или поляризация – это дополнительное напряжение (сверх эдс поляризации), необходимое для поддержания определенной скорости осаждения на электроде. Электрод, потенциал которого отличается от равновесного, называется поляризованным.
Различают концентрационную и активационную поляризацию (перенапряжение). Основные причины вызывающие перенапряжение:
- замедленная доставка вещества к электроду посредством диффузии;
- замедленная стадия присоединения (или отдача) электрона;
- замедленная стадия образования новой фазы (образование газообразного продукта реакции, построение кристаллической решетки и др.);
- замедленный разряд ионов, замедленная диссоциация при электролизе комплексных соединений и др.
перенапряжение меняется в ходе проведения электролиза, его трудно воспроизвести; перенапряжение уменьшается при перемешивании и нагревании раствора, при понижении плотности тока. Более высокое перенапряжение наблюдается на гладких электродах из мягких материалов (Pb, Hg и др.). Особенно заметно перенапряжение при выделении газов и практически отсутствует при выделении металлов. Значения перенапряжения при выделении кислорода и водорода на электродах из различных металлов являются справочными данными. перенапряжение возникает за счет процессов, происходящих на катоде (ηк) и на аноде (ηа), тогда:
Еразл = (Еа+ ηа) - (Ек+ ηк) + IR (6)
Используя это уравнение, можно рассчитать величину напряжения для проведения электролиза. Например, при электролизе CuSO4([Cu2+] = 0,1моль/л; [H+] = 1моль/л) на платиновых электродах  ;
;  .
.
Катодный и анодный потенциал рассчитывают по уравнению Нернста:
на катоде:
| Cu2++2ē→Cu0 |
В начале процесса

 ;
;
при полном осаждении меди 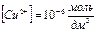 ,
,  ;
;
ηк при выделении меди равно нулю.
на аноде:
| H2O→2H++½O2+2ē |
 .
.
Перенапряжение при выделении О2 на платине,
 , тогда Еразл=2,01-0,171=1,84 В.
, тогда Еразл=2,01-0,171=1,84 В.
В конце процесса в растворе накапливается достаточное количество ионов Н+. Учитывая перенапряжение выделение водорода на платиновом, но уже омедненном электроде (η(Н2)= - 0,94), можно рассчитать, что водород начнет выделяться при:
Еразл = 2,01-(-0,94) = 2,95 В.
Чтобы случайно выделившийся водород не испортил осадок, в электролит вводят азотную кислоту (деполяризатор), которая в растворе восстанавливается до NO2-, NH4+, тогда при Еразл≈ 1 В (легко рассчитать) опасаться выделение водорода не приходится. В конце электролиза добавляют мочевину CO(NH2)2:
CO(NH2)2 + 2NO2- + 2H+ → 3H2O + CO2 + 2N2
Таким образом, электрическое определение меди следует проводить при напряжении 2,0 В, в присутствии деполяризатора HNO3 и мочевины, при перемешивании и нагревании.

|
| Рис. 4. Установка для проведения электролиза. |
Электролиз проводят в химическом стакане, в который помещают цилиндрические электроды из платиновой сетки. Меньший по диаметру анод устанавливают концентрично внутри катода. Электроды соединяют с источником постоянного тока, силу тока контролируют с помощью последовательно включенного амперметра. Скользящий контакт позволяет регулировать напряжение, контролируемое параллельно включенным вольтметром, раствор перемешивают магнитной мешалкой.
Дата добавления: 2016-01-04; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
