Распределение Максвела–Больцмана.
Барометрическая формула для центрально-симметричного поля тяготения.Найдем зависимость давления газа в атмосфере планеты от расстояния до центра в пространстве над поверхностью планеты

Барометрическая формула. Здесь M – масса планеты, G – гравитационная постоянная, m – масса отдельной молекулы .Это барометрическая формула для центрально-симметричного поля тяготения для пространства R ≥ R0.
Барометрическая формула для однородного поля тяготения.У многих планет газовая оболочка очень тонкая. У Земли, например, она не более 4-5% радиуса. Поэтому при малых перепадах высот изменением напряженности поля тяготения можно пренебречь и считать его постоянным. Формула в этом случае упрощается.
Обозначим R = R0 + h, где h<<R0. Тогда  и
и  . Здесь
. Здесь  - ускорение силы тяжести на поверхности планеты.Þ
- ускорение силы тяжести на поверхности планеты.Þ  .
.
Барометрическая формула для однородного поля тяготения
Распределение Больцмана.Если в барометрической формуле перейти от давления к концентрации по формуле Клаузиуса p = nkT, то получаем закон распределения молекул газа по высоте в однородном поле силы тяжести.
 или
или  или
или  . В показатель экспоненты входит потенциальная энергия молекул в поле силы тяжести П = mgh. Так что
. В показатель экспоненты входит потенциальная энергия молекул в поле силы тяжести П = mgh. Так что  . Распределение Больцмана, 1866.
. Распределение Больцмана, 1866.
 Распред молекул или каких-то других частиц в потенциальном силовом поле в услов теплового равновесия по величине потенциальной энергии назыв распределением Больцмана. Физическая природа силового поля роли не играет. Важно лишь, чтобы поле было постоянно и консервативно. Поэтому распред вида применимо и к другим объектам природы, например, к эл-м проводимости в металлах.
Распред молекул или каких-то других частиц в потенциальном силовом поле в услов теплового равновесия по величине потенциальной энергии назыв распределением Больцмана. Физическая природа силового поля роли не играет. Важно лишь, чтобы поле было постоянно и консервативно. Поэтому распред вида применимо и к другим объектам природы, например, к эл-м проводимости в металлах.
|
|
|
Функция распределения.Благодаря тому, что молекулы реальн газов имеют конечный объем и потому часто сталк друг с другом, их скорости изменяются. Но оказывается, что в любой момент времени распределение молекул по скоростям, как показывают теория и опыт, вполне опред и единственно возможное.
Задачу о распределении молекул по скоростям можно сформулировать так: какая часть молекул обладает скоростями, лежащими в некотором интервале вблизи заданной скорости.
 Рассмотрим газ в некотором объеме, в котором отсутствуют силовые поля. Пусть n – концентрация молекул, то есть число молекул в единице объема, а dn/n – доля тех молекул, скорости которых лежат в интервале значений от u до u + du, где du – ширина интервала скоростей. Очевидно, что чем шире интервал du, тем больше доля молекул, чьи скорости в нем заключены, dn/n ~ du.
Рассмотрим газ в некотором объеме, в котором отсутствуют силовые поля. Пусть n – концентрация молекул, то есть число молекул в единице объема, а dn/n – доля тех молекул, скорости которых лежат в интервале значений от u до u + du, где du – ширина интервала скоростей. Очевидно, что чем шире интервал du, тем больше доля молекул, чьи скорости в нем заключены, dn/n ~ du.
Можно предположить, что коэффициент пропорциональности между этими величинами для разных скоростей разный и является функцией скорости u. Тогда соотношение переходит в равенство. dn/n =f(u)du.
|
|
|
 Функцию f(u) называют функцией распределения. Ее нашел теоретически Джеймс Максвелл в 1859 г.
Функцию f(u) называют функцией распределения. Ее нашел теоретически Джеймс Максвелл в 1859 г.  . Функция распределения, Дж. Максвелл, 1859
. Функция распределения, Дж. Максвелл, 1859
Здесь B = m|2kT, A = 4π(m|2πkT)3| 2= 4π(B|π)3| 2, где m – масса каждой молекулы, T – абсолютная температура газа, k – постоянная Больцмана. Функция получена методами теории вероятностей на основе гипотезы о равновероятности всех направлений скоростей молекул.
Максвелловское распределение молекул по скоростям является равновесным. Каково бы ни было распределение в начальный момент времени, оно все равно в конечном счете перейдет в максвелловское f(u). Это доказал Больцман в 1871 г.
 Uв - это скорость, на которую приходится максимум функции распределения f(u).
Uв - это скорость, на которую приходится максимум функции распределения f(u).


Опыты Штерна.Прямой проверочный эксперимент поставил впервые Отто Штерн в 1920 г. с помощью атомных пучков.
 Два коаксиальных жестко связанных между собой цилиндра радиусами R1 и R2 вращались с угловой скоростью ω сначала в одну сторону, затем в другую. Платиновая нить, покрытая серебром и натянут вдоль геометр оси цилиндров, нагревалась до температуры около 1300 K. При этом серебро испарялось. (Tпл серебра 1235 К). Часть испар-ся атомов серебра, пройдя через щель Щ, формировали узкий пучок. Скорость v движения атомов в этом пучке находилась так.
Два коаксиальных жестко связанных между собой цилиндра радиусами R1 и R2 вращались с угловой скоростью ω сначала в одну сторону, затем в другую. Платиновая нить, покрытая серебром и натянут вдоль геометр оси цилиндров, нагревалась до температуры около 1300 K. При этом серебро испарялось. (Tпл серебра 1235 К). Часть испар-ся атомов серебра, пройдя через щель Щ, формировали узкий пучок. Скорость v движения атомов в этом пучке находилась так.
|
|
|
За время движения атомов между цилиндрами t = (R2 - R1)/v цилиндры поворачиваются на угол j=wt = w(R2 - R1)/v. Атомный осадок на внутренней стенке большого цилиндра смещается относительно центральной проекции щели (точка А) в точки B или C на расстояние a = R2j= wR2(R2 - R1)/v. Отсюда находится скорость движения атомов в пучке.
 . Штерн получил из опытов v » 600 м/с для атомов серебра при температуре нити 1300 К. Это качественно согласуется с распределением Максвелла. Наиболее вероятная скорость для атомов серебра
. Штерн получил из опытов v » 600 м/с для атомов серебра при температуре нити 1300 К. Это качественно согласуется с распределением Максвелла. Наиболее вероятная скорость для атомов серебра 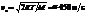 , среднеквадратичная скорость vкв » 550 м/с. Если учесть, что расстояние a до центра пятна на внутр поверхности большого цилиндра находилось по визуальной плотности осадка, это неплохое соответствие теории эксперименту.
, среднеквадратичная скорость vкв » 550 м/с. Если учесть, что расстояние a до центра пятна на внутр поверхности большого цилиндра находилось по визуальной плотности осадка, это неплохое соответствие теории эксперименту.
Сравнение осадка в точке A, полученного при покоящихся цилиндрах, с осадками в точках B и C показало, что если края полосы в точке A резко очерчены, а осадок в пределах полосы однородный, то края полос B и C размыты, плотность осадка убывает от середины к краям. Это говорит о том, что скорости атомов в пучке разные.
Недостаток первых опытов Штерна состоял в том, что атомы серебра выходили не из газа, а с поверхности твердого тела. Поэтому они несли информацию о распределении скоростей не в газе, а в твердом теле.
|
|
|
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
Пусть сист переходит из некот начального состояния 1 в конечное состояние 2, такой переход наз-ся прямым.Тогда переход 2-1 – это обра
тный процесс. Будем полагать, что в обр-ом процессе происх-т та же по
след-сть, что и в прямом. Процесс обратим, если сущ-ет обратный по отн-ию к нему и, если последовательное совершение прямого и обр-го процессов не ост-ет никаких следов в окр-их телах. Исходные формул
ировки 2 ТД.Формулировка Клаузиуса: Тепло само сабой переходит только от более нагретых тел к менее нагретым телам.
Формулировка Кельвина: Тепло, отнятое у к-н тела нельзя нацело прев
ратить в работу без всякой компенсации.Эквивалентность форм-к Кель
 вина и Клаузиуса. Допустим, что не верна формулировка Клаузиуса. Требуется доказать, что при этом б нарушаться формулировка Кельвина. Допустим, Т1>Т2
вина и Клаузиуса. Допустим, что не верна формулировка Клаузиуса. Требуется доказать, что при этом б нарушаться формулировка Кельвина. Допустим, Т1>Т2
Можно придумать такую машину, в кот отнятое тепло нацело превращалось в работу.Т1>Т2 , A=Q1-Q2
Если q=Q, то машина циклически возвр в начальн состоян. Нагреватель отдает тепла Q1-Q2. Т о пришли к противоречию с формул-кой Кельв
ина.Допустим неверность формул-ки Кельвина.
Существует такая циклич машина, кот отняв тепло нацело превращает его в работу. Если такая машина есть,то воз-на ситуация, когда от холодного тела к горячему само собой переходит тепло. Нарушена формул-ка Кла
узиуса.
Теорема Карно.
Цикл Карно: Прямой цикл может использоваться для превращения теплоты в работу. Он открывает путь к созданию тепловых машин.Для реализации цикла нужны 3 тела: нагреватель – более нагретое тело, холодильник – менее нагретое тело, рабочее тело – в нашем случае – идеальный газ. Форма циклов может быть какой угодно, лишь бы они были замкнуты.В 1824 г. Сади Карно предложил цикл, составленный из двух изотерм и двух адиабат. Исследование этого цикла позволило выявить в нем замечательные свойства и использовать его позднее как метод изучения термодинамических систем.Пусть рабочим телом являются n молей идеального газа, исходное состояние 1 которого имеет параметры p1, V1, T1 (рис.13).Теплоемкость нагревателя и холодильника полагаем настолько большой, что их температуры при теплообмене с рабочим телом не меняются. Такие тела называют еще термостатами. Температура холодильника T2 < T1. Рассмотрим процессы цикла.а. Изотермическое расширение 1®2, T1 = const. В исходном состоянии 1 рабочее тело (идеальный газ) имеет тепловой контакт с нагревателем. Газ расширяется при T1 = const, давление падает по изотерме от p1 до p2. Подводимая к газу теплота полностью превращается в работу, так как изменение внутренней энергии DU1®2 = 0.б. Адиабатное расширение 2®3, Q2®3 = 0. Рабочее тело теплоизолируется и расширяется от объема V2 до объема V3 так, что его температура падает от температуры нагревателя T1 до температуры холодильника T2. Работа расширения газа совершается за счет его внутренней энергии.  .в. Изотермическое сжатие 3®4, T2 = const. Газ сжимается внешними телами при температуре холодильника T2 от объема V3 до V4. Работа сжатия выделяется в виде теплоты Q2 и через тепловой контакт отдается холодильнику. Изменение внутренней энергии DU3®4 = 0.
.в. Изотермическое сжатие 3®4, T2 = const. Газ сжимается внешними телами при температуре холодильника T2 от объема V3 до V4. Работа сжатия выделяется в виде теплоты Q2 и через тепловой контакт отдается холодильнику. Изменение внутренней энергии DU3®4 = 0.  .
.
г. Адиабатное сжатие 4®1, Q4®1 = 0. Газ теплоизолируется и адиабатно сжимается внешними телами до параметров начального состояния p1, V1, T1. Работа адиабатного сжатия на последнем этапе  Суммарная работа цикла A = A1®2 + A2®3 + A3®4 + A4®1 = A1®2 + A3®4
Суммарная работа цикла A = A1®2 + A2®3 + A3®4 + A4®1 = A1®2 + A3®4
определяется лишь изотермическими процессами. В адиабатических процессах работа одинакова по величине, но противоположна по знаку. Поэтому ее сумма равна нулю. Эффективность функционирования любой тепловой машины определяется коэффициентом полезного действия h, равным отношению работы A к количеству полученной от нагревателя теплоты Q1
η=A/Q1=Q1-Q2/Q1 Для машины с ид газом: η=T1-T2/T1 .
Q1-Q2/Q1≤ T1-T2/T1 - теорема Карно (= для обрат машин,
<для необрат машин) Полученная формула выражает первую теорему Карно: коэффициент полезного действия тепловой машины, работающей по идеальному циклу Карно, зависит только от температур Т1 и T2 нагревателя и холодильника, но не зависит от устройства машины и вида используемого рабочего вещества.
Из теоремы Карно следует, что без перепада температур нельзя теплоту превратить в работу.
КПД идеального цикла Карно является наибольшим из всех реальных и мыслимых процессов. Этот факт составляет содержание 2-й теоремы Карно: коэффициент полезного действия всякой тепловой машины не может превосходить коэффициента полезного действия идеальной машины, работающей по циклу Карно с теми же самыми температурами T1 и T2 нагревателя и холодильника.
Равенство и неравенство Клаузиуса. Преобразуем выражение КПД идеального цикла Карно.
 По предложению Лоренца отношение Q| T называют приведенной тепл
По предложению Лоренца отношение Q| T называют приведенной тепл
отой.Следовательно,сумма приведенных теплот,кот обменивается с окружающими телами рабочее тело, в идеальном цикле равна нулю.
В реальном цикле к теплоте Q2, отдаваемой холодильнику, добавляется тепло от работы сил трения, поэтому в целом Q2| T2 оказывается больше по модулю члена Q1| T1. Поэтому сумма приведенных теплот оказ-ся в целом отрицательной, равенство переходит в неравенство.

При обобщении задачи теплоту Q рассматривают как алгебраическую величину, записывая со знаком «+». Кроме того цикл может состоять из множества процессов, тогда формула записывается так:
 . Перейдем к пределу и получим
. Перейдем к пределу и получим 
Энтропия..Рассм произвольный цикл, выделим 2 процесса a и b


Предположим, что цикл является обратимым.
 Интеграл от приведенной теплоты не зависит от пути интегри
Интеграл от приведенной теплоты не зависит от пути интегри
рования, то подинтегральная функция – полный диференциал некот ф-и состояния системы. dS=dQ/T. Клаузиус предположил, что новая функция состояния – энтропия, может быть определена для люб сист, как равновесных, так и неравновесных.dS≥dQ/T
Записанное соотношение имеет след смысл:
· Сущ для любых систем некот ф-я сост, кот мы называем энтропией.
· Эта ф-я такова, что в равнов процессах ее изменение равно приведенной теплоте.
· В неравнов процессах – измен энтропии больше привед теплоты.
Записанное и есть осн формулировка 2 нач термодинамики, п ч энтропия определена для люб системы, а значит и для люб процессов.
Энтропия изолированной системы не убывает, она м только возрастать, а если система в равновесии, то она остается постоянной.
Дата добавления: 2018-02-18; просмотров: 604; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
