Темы для реферативных сообщений
1. Липиды в качестве лекарственных препаратов и биологически активных добавок (эссенциале, лецитин, холевая кислота, w‑3–жирные кислоты и др.).
2. Ненасыщенные, полиненасыщенные жирные кислоты, витамин F (структурная роль, участие в обмене фосфолипидов, поведенческих реакциях).
3. Белая и бурая жировая ткань: распределение и роль в организме, метаболические особенности.
4. Современные представления о роли L-карнитина в организме, участие в пре- и постнатальном развитии.
5. Атеросклероз: причины, механизмы развития, последствия и современные подходы к лечению.
6. Метаболический синдром (синдром Х): причины, связь с ожирением, атеросклерозом, сахарным диабетом II типа и гипертензией, основы лечения.
7. Болезни накопления липидов: Нимана-Пика, Тея-Сакса, Гоше, Шюллера-Кристиана, Вольмана. Молекулярные причины, механизмы развития, основы лечения.
Лабораторная работа 1.
Определение содержания общих липидов
в сыворотке крови
Понятие "общие липиды" объединяет сумму всех липидов, содержащихся в плазме/сыворотке крови в составе транспортных липопротеинов, а также свободных жирных кислот, которые переносятся в кровеносном русле альбумином.
Принцип
Для оценки содержания липидов в сыворотке крови их сначала гидролизуют концентрированной Н2SО4. Продукты распада липидов образуют с сульфованилиновым реактивом соединение желтого цвета, интенсивность окраски которого пропорциональна концентрации липидов и определяется колориметрически.
|
|
|
Реактивы
1) конц. H2SO4, 2) фосфорнованилиновая смесь (конц. H3PO4 смешивают с 0,6% раствором ванилина в соотношении 4:1), 3) 0,6% раствор триолеина (стандарт).
Материал для исследования
Сыворотка крови.
Проведение анализа
| Опыт, мл | Стандарт, мл | Контроль, мл | |
| Сыворотка крови Стандартный раствор липидов Дистилл. вода Серная кислота | 0,05 – – 2,5 | – 0,05 – 2,5 | – – 0,05 2,5 |
| Нагревают 10 мин на кипящей водяной бане. Отбирают по 0,2 мл из всех проб и переносят в следующие три пробирки, маркируя соответственно. | |||
| Фосфорнованилиновая смесь | 3,0 | 3,0 | 3,0 |
| Выдерживают 45 мин при комнатной температуре в темноте. Колориметрируют опытную и стандартную пробы против контроля при длине волны 500‑560 нм в кювете 0,5 см. | |||
Расчет
Общие липиды [ г/л] = 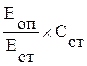
где: ЕОП – оптическая плотность пробы, ЕСТ – оптическая плоность стандарта, ССТ – концентрация стандартного раствора
Нормальные величины
Сыворотка крови 4,0‑8,0 г/л.
Практическое значение
Содержание общих липидов в крови повышается (гиперлипемия) при ожирении, атеросклерозе, у больных ишемической болезнью сердца и сахарным диабетом, при заболеваниях почек (липоидный нефроз), панкреатите, алкоголизме, гипотиреозе, поражении печени (цирроз, острый гепатит).
|
|
|
Оформление работы
Указывают принцип метода. Производят расчеты. Сравнивают результаты с нормальными величинами. Делают заключение об особенностях состояния и возможной патологии пациента, указывают практическое значение метода.
Более информативным для диагностики заболеваний является определение отдельных липидных фракций (ТАГ, холестерол, фосфолипиды, различные липопротеины) и расчет на их основе диагностических индексов и коэффициентов.
Лабораторная работа 2.
Определение содержания общего холестерола
в сыворотке крови
Принцип
Используется сопряжение ферментативных реакций, катализируемых холестеролэстеразой, гидролизующей эфиры холестерина до его свободной формы, а также холестеролоксидазой, превращающей холестерин в холестенон с образованием Н2О2, и пероксидазой, окисляющей 4‑аминоантипирин пероксидом водорода в присутствии фенола с получением продукта розово-малинового цвета.
Реактивы
1) рабочий реактив (холестеролэстераза (200 Е/л), холестеролоксидаза (100 Е/л), пероксидаза (80 Е/л), фенол (6,0 мМ), 4‑аминоантипирин (0,5 мМ) в 0,1 М калиевофосфорном буфере), 2) стандартный раствор холестерола (4,65 ммоль/л)
|
|
|
Материал для исследования
Сыворотка крови.
Нормальные величины
| Сыворотка | 20‑29 лет 30‑39 лет 40‑49 лет старше 50 лет | 3,70‑6,51 ммоль/л 4,25‑7,04 ммоль/л 4,37‑7,70 ммоль/л 4,55‑8,24 ммоль/л |
Проведение анализа
| Опыт, мл | Стандарт, мл | Контроль, мл | |
| Дистиллиров. вода Сыворотка Стандарт Рабочий реактив | – 0,02 – 2,0 | – – 0,02 2,0 | 0,02 – – 2,0 |
| Инкубируют 20 мин при 37°С. Колориметрируют против контроля, 500 нм (зеленый с/фильтр), кювета 0,5 см. | |||
Расчет
Холестерол [ммоль/л] = 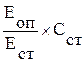 ,
,
где ЕОП и ЕСТ ‑ оптическая плотность опытной и стандартной пробы,
ССТ ‑ концентрация холестерола в стандартной пробе.
Практическое значение
Гиперхолестеролемия приводит к раннему развитию атеросклероза и его клинических осложнений ‑ ишемической болезни сердца, инсульта. К нарушениям обмена холестерола относят желчекаменную болезнь. Высокое содержание холестерола в крови выявляется при гиперлипидемиях (типы IIа, IIб и IV), нефротическом синдроме, диабете. Гипохолестеролемия наблюдается при гипопротеинемии, циррозе печени, злокачественных опухолях.
|
|
|
Оформление работы
Указывают принцип метода, фиксируют итоги измерений, производят расчет. Сравнивают результат с нормальными величинами. Делают вывод о возможной патологии пациента, значении метода.
Лабораторная работа 3.
Определение в сыворотке крови холестерола липопротеинов и индекса атерогенности
Принцип
Метод основан на осаждении липопротеинов низкой плотности (ЛПНП) и липопротеинов очень низкой плотности (ЛПОНП) магния хлоридом и определении содержания общего холестерола в исходной сыворотке и холестерола липопротеинов высокой плотности (ЛПВП) в надосадочной жидкости после осаждения других фракций липопротеинов. Результаты используют для расчета суммарного холестерола ЛПНП и ЛПОНП, а также индекса атерогенности.
Материал для исследования
Сыворотка крови.
Реактивы
1) 0,5М раствор MgCI2 в 4 % фосфорновольфрамовой кислоте, 2) набор реактивов для определения содержания холестерола (см предыдущую работу).
Проведение анализа
К 1,0 мл сыворотки крови прибавляют 1,0 мл раствора MgCI2. Для осаждения ЛПНП и ЛПОНП инкубируют 30 мин в ледяной бане, центрифугируют 15 мин при 3000 об/мин, надосадок переносят в другую пробирку, закрывают пробкой.
Далее определяют концентрацию холестерола набором реактивов:
в 1-ю пробирку вносят 0,02 мл исходной сыворотки крови (для определения общего холестерола или используют в расчетах данные предыдущей работы), во 2-ю пробирку ‑ 0,02 мл надосадочной жидкости (для определения холестерола ЛПВП), в 3-ю пробирку ‑ 0,02 мл стандартного раствора холестерола, в 4-ю пробирку ‑ 0,02 мл дистиллированной воды (контроль).
Следующие этапы проводят согласно указаниям предыдущей работы.
Расчет
Расчет содержания общего холестерола ‑ см. в предыдущей работе.
Полученные при анализе 2-й и 3-й пробирок данные используют для расчета содержания холестерола ЛПВП по формуле:
Холестерол ЛПВП [ммоль/л] = 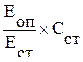
где ЕОП и ЕСТ ‑ оптическая плотность опытной и стандартной пробы,
ССТ ‑ концентрация холестерола в стандартной пробе.
Суммарное содержание холестерола ЛПНП и ЛПОНП рассчитывают по формуле:
[ХСЛПНП+ЛПОНП] = ХСОБЩИЙ – ХСЛПВП
Риск развития атеросклероза прогнозируют, используя индекс атерогенности. Рассчитывают его по формуле:
Индекс атерогенности = (ХСОБЩИЙ – ХСЛПВП) : ХСЛПВП
Нормальные величины
| Сыворотка крови | |
| Холестерол ЛПВП | 0,9‑1,9 ммоль/л |
| Индекс атерогенности 20 ‑30 лет больше 30 лет | 2,0‑2,8 3,0‑3,5 |
Практическое значение
Увеличение концентрации холестерола ЛПВП клинически не значимо, наблюдается при доброкачественных состояниях. Снижение содержания холестерола ЛПВП указывает на угрозу атеросклероза. Увеличение индекса атерогенности до 4 и более наблюдается при ишемической болезни сердца и атеросклерозе.
Оформление работы
Указывают принцип метода, фиксируют полученные результаты, делают расчеты и вывод о возможных нарушениях, прогнозе развития атеросклероза и о практическом значении работы.
Лабораторная работа 4.
Экспресс-метод обнаружения кетоновых тел в сыворотке крови и моче
Принцип
Определение кетоновых тел основано на реакции Легаля, учитывающей способность ацетона и ацетоацетата в щелочной среде реагировать с нитропруссидом натрия с образованием комплексов оранжево-красного цвета, превращающихся при подкислении раствора в соединения вишнево-красного, фиолетового цвета (проба более чувствительна к ацетоацетату, чем к ацетону, с b‑гидрокси-масляной кислотой реакция не идет). Метод полуколичественный, интенсивность развивающейся окраски пропорциональна концентрации кетоновых тел.
Материалы для исследования
Моча нормальная, моча с добавлением ацетона, сыворотка крови.
Реактивы
Диагностические полоски "Кетофан".
Проведение анализа
Полоску берут из пенала упаковки, не прикасаясь руками к желтым зонам индикации. Опускают полоску на 1‑2 сек в исследуемую жидкость (мочу или сыворотку крови), лишнюю жидкость удаляют, проводя полоской по краю сосуда. Полоски оставляют в горизонтальном положении и через 1 мин сопоставляют окраску зон индикации для кетоновых тел с цветной шкалой на этикетке упаковки. Концентрацию кетоновых тел определяют по таблице:
| Порядковый номер по шкале | 1 | 2 | 3 | 4 |
| Концентрация кетоновых тел (ммоль/л) | 1,0‑2,0 | 2,0‑4,9 | 4,9‑14,7 | >14,7 |
Нормальные величины
| Сыворотка крови | 0,1‑0,6 ммоль/л |
| Моча | отсутствие |
Практическое значение
Увеличение содержания кетоновых тел в крови (кетонемия) наблюдается при тяжелых формах диабета, повышении уровня жиромобилизующих гормонов (в 100‑1000 раз), голодании. Кетонемия сопровождается появлением кетонов в моче ‑ кетонурия. Патологическое состояние, вызванное токсическим действием кетоновых тел, носит название "кетоз".
Оформление работы
Указывают принцип метода, заполняют таблицу, отображая в графе «результаты» получаемую окраску, присутствие (+) или отсутствие (–) кетоновых тел и глюкозы. Делают вывод, указывают практическое значение метода.
| Метод | Объект исследования | Выявляемое вещество | Результаты |
| Полоски | Моча нормальная |
| |
| Моча патологическая | |||
| Сыворотка крови |
Вопросы для самоконтроля
1. Синтез жирных кислот, роль цитрата, малонил~КоА, участие НАДФН, синтазы жирных кислот, значение и регуляция процесса.
2. Транспорт жирных кислот в крови. Этапы и реакции окисления жирных кислот до СО2 и Н2О, роль карнитина и витаминов, энергетика.
3. Пути и реакции синтеза глицерола, окисление до СО2 и Н2О, энергетика.
4. Липогенез из глюкозы (глицерол, жирные кислоты и НАДФН), значение пирувата и ацетил~КоА. Транспорт ТАГ с участием хиломикронов и ЛПОНП, обмен ТАГ в тканях, ферменты, регуляция и нарушения обмена, особенности обмена при голодании, насыщении, работе мышц. Бурый и белый жир.
5. Синтез и утилизация кетоновых тел, роль сукцинил~КоА и оксалоацетата. Причины и последствия кетоацидоза. Значение кетоновых тел.
6. Синтез холестерола, роль промежуточных продуктов синтеза (липидные якоря, образование долихола), участие НАДФН, регуляция. Транспорт холестерола с участием ЛПНП, ЛПВП, пути использования в организме, выведение.
7. Пути синтеза фосфолипидов, роль фосфатидной кислоты и липотропных веществ (витамины, аминокислоты, холин, инозитол и др.), значение ЦТФ, АТФ. Ключевые фосфолипазы, использование фосфолипидов в синтезе биологически активных веществ и передаче информации в клетку.
8. Патологии, связанные с обменом липидов: ожирение, дис- и гиперлипопротеинемии, атеросклероз, жировое перерождение печени, сахарный диабет и кетоацидоз, желчекаменная болезнь. Липидозы как лизосомное накопление.
Тестовые задания
Выбрать один правильный ответ.
1. Стероидами являются
1) желчные кислоты
2) ганглиозиды
3) сфингомиелины
4) гормоны гипофиза
5) гормоны мозгового вещества надпочечников
2. Незаменимым фактором питания является
1) холестерол
2) фосфатидилхолин
3) линоленовая кислота
4) олеиновая кислота
5) желчная кислота
3. Катаболизм высших жирных кислот происходит по пути
1) декарбоксилирования
2) гликогенолиза
3) b-окисления
4) липолиза
4. Через мембрану митохондрий остаток жирной кислоты переносит
1) карнозин
2) карнитин
3) креатин
4) кератин
5) креатинин
5. Источником НАДФН для синтеза жирных кислот является
1) пентозофосфатный путь
2) катаболизм триацилглицеролов
3) окислительное декарбоксилирование пирувата
4) реакции гликолиза
5) реакции ЦТК
6. В составе хиломикронов обнаруживают
1) около 90 % триацилглицеролов и 2 % белков
2) около 50 % холестерола и его эфиров
3) около 50 % белков и 20 % холестерола и его эфиров
4) около 10 % белков и 50–55 % триацилглицеролов
7. При голодании кетоновые тела не используются
1) нервными клетками
2) скелетными мышцами
3) кардиомиоцитами
4) гепатоцитами
8. При длительном голодании активируется
1) липогенез в жировой ткани
2) b-окисление жирных кислот в печени
3) синтез холестерола в нервной ткани
4) цикл трикарбоновых кислот в печени
5) синтез жирных кислот в сердце
9. Ключевую реакцию синтеза холестерола катализирует
1) гидроксиметилглутарил-SКоАредуктаза
2) ацилтрансфераза
3) пируваткиназа
4) ацетоацетил-SКоАсинтаза
5) оксиметилглутарил-SКоАсинтетаза
10. Синтез жиров в жировой ткани стимулирует гормон
1) адреналин
2) глюкагон
3) кортизол
4) инсулин
5) тироксин
Ситуационные задачи
1. У больного при зондировании двенадцатиперстной кишки установлена задержка оттока желчи из желчного пузыря. Указать, влияет ли это на переваривание жиров. Пояснить, какие последствия может иметь такая патология.
2. Содержание триацилглицеролов и фосфолипидов в сердечной мышце в 1,5‑2 раза больше, чем в скелетной мускулатуре. Пояснить биохимический смысл этих различий. Показать, связана с этим высокая чувствительность миокарда к кислородной недостаточности или не связана.
3. Родители обеспокоены излишним весом ребенка. Не посоветовавшись с врачом, они резко ограничили количество сахара в пище ребенка, увеличив содержание белка, но не уменьшив количество жира. Через несколько недель у ребенка ухудшилось самочувствие, появилась рвота. Указать, с нарушением какого обмена это связано и почему. Пояснить, какой биохимический анализ подтвердит нарушение этого вида обмена.
ТЕМА
"Обмен углеводов и липидов. Биоэнергетика"
(контрольное занятие по разделам 3, 4 и 5)
Вопросы для самоподготовки
Биоэнергетика
1. Понятие обмена веществ. Фазы обмена веществ (распад и синтез), их взаимосвязь. АТФ и другие высокоэнергетические соединения, значение НАДФН. Цикл АТФ‑АДФ. Основные пути фосфорилирования АДФ и использования АТФ.
2. Схема катаболизма питательных веществ, этапы (специфические и общие пути), их значение и конечные продукты.
3. Окислительное декарбоксилирование пирувата: последовательность реакций, связь с дыхательной цепью, регуляция, участие витаминов и их характеристика(биологическое название, признаки недостаточности, суточная потребность, пищевые источники). Лекарственные препараты, применяемые для коррекции нарушений окислительного декарбоксилирования.
4. Цикл трикарбоновых кислот: последовательность реакций, участие витаминов, связь с дыхательной цепью, энергетический эффект, регуляция. Пути стимуляции цикла трикарбоновых кислот. Анаплеротические реакции пополнения метаболитов ЦТК.
5. Биологическое окисление (тканевое дыхание), теории Баха и Паладина, современные представления. Окислительные и неокислительные пути образования СО2. Получение воды и СО2 в процессе тканевого дыхания. Функции дыхательной цепи.
6. Окислительное фосфорилирование цепи переноса электронов и субстратное фосфорилирование ЦТК. Структурная организация митохондриальной цепи переноса электронов, ферменты и коферменты. Митохондриальый потенциал, механизм сопряжения окисления с фосфорилированием в дыхательной цепи. Механизм образования АТФ с участием Н+‑АТФсинтетазы.
7. НАД–зависимые дегидрогеназы: строение окисленной и восстановленной форм НАД, активный центр, характеристика витамина, входящего в состав НАД (название, суточная потребность, пищевые источники, недостаточность), важнейшие субстраты, НАДН–дегидрогеназа и переносчики электронов дыхательной цепи митохондрий, коэффициент Р/О.
8. ФАД‑зависимые дегидрогеназы: строение окисленной и восстановленной форм ФАД, активный центр, характеристика витамина, входящего в состав ФАД (название, признаки недостаточности, суточная потребность, пищевые источники), важнейшие субстраты, дальнейший путь электронов в дыхательной цепи, окислительное фосфорилирование и коэффициент Р/О.
9. Дыхательный контроль. Разобщение дыхания и фосфорилирования. Ингибиторы дыхательной цепи, блокаторы процессов тканевого дыхания, ионофоры. Гипоэнергетические состояния. Термогенез.
Обмен углеводов
1) Углеводы и их роль в организме. Классификация углеводов по структуре и функциям. Строение основных представителей углеводов: моно‑, ди‑, полисахариды (пентозы, глюкоза, мальтоза, галактоза, сахароза, крахмал, целлюлоза, гликоген). Представление о структуре гликозаминогликанов (мукополисахаридов): гиалуроновая, хондроитинсерная кислоты, гепарин. Углеводы ‑ лекарственные препараты.
2) Углеводы пищи, переваривание и всасывание. Особенности переваривания в полости рта и тонком кишечнике. Ферменты полостного пищеварения углеводов и пристеночные комплексы. Нарушения функционирования ферментов, последствия.
3) Роль печени в обмене углеводов. Депонирование глюкозы, условия. Взаимопревращения углеводов: метаболизм галактозы и фруктозы в печени и его нарушения.
4) Биосинтез и мобилизация гликогена: последовательность реакций, физиологическое значение. Регуляция активности фосфорилазы и синтазы гликогена (роль цАМФ, ионов кальция и кальмодулина). Особенности обмена гликогена в печени и в мышцах. Гликогенозы и агликогенозы.
5) Пути превращения глюкозы в тканях. Распад углеводов в анаэробных условиях: гликолиз, гликогенолиз ‑ последовательность реакций, балансовые уравнения, энергетический эффект, способ образования АТФ, локализация процессов. Сходства и отличия гликолиза, гликогенолиза и спиртового брожения. Дальнейшая судьба молочной кислоты.
6) Превращения углеводов в аэробных условиях. Аэробный распад глюкозы: последовательность реакций, энергетический эффект. Биохимические механизмы эффекта Пастера. Роль аэробного распада глюкозы в мозге.
7) Пентозофосфатный путь превращения глюкозы. Химизм окислительной стадии и НАДФН, понятие о реакциях и ферментах системы структурной перестройки. Регуляция процесса, взаимосвязь с гликолизом. Роль пентозофосфатного пути в эритроцитах и лейкоцитах, клетках активно пролиферирующих тканей организма. Наследственная энзимопатия глюкозо‑6-фосфат-дегидрогеназы.
8) Биосинтез глюкозы (глюконеогенез): возможные предшественники, последовательность реакций, источники энергии и ферменты. Глюкозо‑лактатный цикл (цикл Кори), глюкозо-аланиновый цикл. Значение глюконеогенеза, регуляция глюконеогенеза гормонами.
9) Регуляция концентрации глюкозы в крови. Пути поступления и пути расходования глюкозы крови. Влияние на эти процессы: инсулина, глюкагона, адреналина и глюкокортикоидов. Изменения обмена углеводов при голодании, стрессе и применении глюкокортикоидов (стероидный диабет).
10) Нарушение обмена углеводов при сахарном диабете, типы сахарного диабета. Врожденные нарушения обмена углеводов (галактоземия, гликогенозы, интолерантность к сахарозе, лактозе).
Обмен липидов
1) Липиды, строение, классификация. Разнообразие липидов в организме. Характеристика основных классов липидов: химическая структура смешанных триацилглицеринов, фосфолипидов (фосфатидилхолина, фосфатидилсерина и фосфатидилэтаноламина), холестерина и его эфиров, физико‑химические свойства, биологическая роль. Представление о химической структуре сфинголипидов и гликолипидов (цереброзидов, ганглиозидов).
2) Высшие жирные кислоты. Классификация, физико-химические свойства. Источники жирных кислот, биологическая роль, транспорт и использование. Структура масляной, стеариновой, пальмитиновой, олеиновой, линолевой, ω-3 и ω-6 линоленовых, арахидоновой кислот. Производные незаменимых жирных кислот: простагландины и лейкотриены, роль, ключевые ферменты синтеза. Особенности жирных кислот, участвующих в механизмах памяти.
3) Внешний обмен липидов. Пищевые жиры: суточная потребность, переваривание, всасывание. Характеристика мицелл. Роль ферментов и желчных кислот. Синтез и строение таурохолевой и гликохолевой кислот.
4) Ресинтез липидов в стенке кишечника. Хиломикроны ‑ основная транспортная форма пищевых липидов; состав, строение, функции. Утилизация хиломикронов в крови и других тканях. Роль липопротеинлипазы. Депонирование.
5) Биологические нормы содержания общих липидов и триацилглицеринов в крови. Причины и последствия нарушений переваривания и всасывания жиров (гиповитаминозы, стеаторея).
6) Основные пути внутриклеточного превращения триацилглицеринов. Гормональная регуляция (схема). Значение основных гормонов.
7) Липолиз ‑ путь мобилизации и катаболизма нейтральных жиров. Роль процесса. Гормончувствительная липаза, роль аденилатциклазной системы в регуляции ее активности. Транспорт и использование жирных кислот, образующихся при липолизе. Жирные кислоты и миокард; белки, связывающие жирные кислоты.
8) b‑Окисление жирных кислот, связь с ЦТК и дыхательной цепью, распад до углекислого газа и воды и энергетический выход. Другие пути использования ацетил‑КоА. Синтез и утилизация кетоновых тел, роль сукцинил-коА и ЦТК. Причины кетоза при голодании и диабете.
9) Химизм синтеза жирных кислот, роль СО2, АТФ и НАДФН.
10) Пути получения глицерина и его обмен, направления утилизации, энергетический выход при распаде. Особенности глюконеогенеза из глицерина и синтез глицерина из глюкозы (роль гликолиза). Регуляция процесса инсулином. Нарушения обмена глицерина.
11) Липогенез. Пути эндогенного синтеза триацилглицеринов. Биосинтез жиров в жировой ткани и в печени. Источники глицерина, жирных кислот, энергии.
12) Синтез триацилглицеринов через фосфатидную кислоту. Липопротеины очень низкой плотности (ЛПОНП) – основная транспортная форма триацилглицеринов печени. Состав, строение, функции, утилизация ЛПОНП в крови и тканях. Роль липопротеинлипазы. Регуляция активности фермента.
13) Понятие сложных липидов. Обмен фосфолипидов, фосфолипазы, значение фосфолипаз А2 и С. Представление о биосинтезе фосфолипидов. Роль аминокислот, витаминов. Источники энергии. Транспортные формы. Нарушение процесса. Липотропные вещества.
14) Холестерол пищи и синтез в организме (до мевалоновой кислоты – химизм, далее – схема с указанием изопентенила, геранила, фарнезила, участия НАДФН), обмен и функции холестерина, роль транспортных липопротеинов в обмене. Направления использования холестерина в организме. Пути выведения холестерина. Нарушение обмена холестерина (атеросклероз, желчекаменная болезнь).
15) Взаимосвязь обмена жиров и углеводов. Схема превращения глюкозы в жиры, степень обратимости процессов. Роль пентозофосфатного пути для синтеза жиров. Влияние гормонов (инсулина, глюкагона, адреналина, глюкокортикоидов) на обмен жиров и углеводов.
16) Ацетил~КоА. Пути образования и пути использования в организме: аэробные превращения глюкозы, жирных кислот, синтез жирных кислот, холестерина, ацетоновых тел.
17) Регуляция обмена липидов. Нарушение обмена липидов: нарушение транспорта из крови в ткани, кетонемия и кетонурия, гиперхолестеринемия, атеросклероз, ожирение, жировая дистрофия печени, гиперлипопротеинемии, наследственные нарушения обмена липидов.
Практическая часть
1. Переваривание углеводов в желудочно-кишечном тракте.
2. Определение кислотного числа жира.
3. Качественная реакция на желчные кислоты.
4. Влияние желчи на активность липазы.
5. Определение наличия молочной кислоты в мышечной ткани и желудочном соке реакцией Уффельмана.
6. Определение концентрации глюкозы в сыворотке крови глюкозооксидазным методом.
7. Влияние сахарной нагрузки на содержание глюкозы в крови, глюкозотолерантный тест.
8. Определение содержания общих липидов в сыворотке крови.
9. Определение содержания триацилглицеринов в сыворотке крови.
10. Определение содержания холестерола в сыворотке крови.
11. Определение в сыворотке крови холестерола липопротеинов и индекса атерогенности.
12. Экспресс-метод определения содержания глюкозы в моче («Биофан-3», «Глюкотест» и др.).
13. Экспресс-метод определения содержания кетоновых тел в моче («Кетофан», «Диафан» и др.).
Раздел 6.
Обмен аминокислот и белков.
Детоксикация аммиака
ТЕМА 6.1.
Внешний обмен белков, гниение в кишечнике и детоксикация в печени
Актуальность
Пищевые продукты животного и растительного происхождения являются главными источниками белков для человека. В желудочно-кишечном тракте идет последовательное расщепление белков до аминокислот. Протеолитические ферменты (класс гидролаз) обладают относительно широкой специфичностью. Пепсин желудочного сока устойчив в сильнокислой среде, условия для активации и действия пепсина создаются в желудке за счет соляной кислоты, pH чистого желудочного сока ‑ 1,0‑2,0. Кроме того, соляная кислота определяет бактерицидность желудочного сока. Патология пищеварения может повлечь за собой нарушение обмена белка и функционирования систем организма. Поэтому методы анализа состава желудочного сока важны для оценки его переваривающей способности в норме и при патологии.
Цель
1. Изучить биологическую ценность пищевых белков, переваривание и всасывание в желудочно-кишечном тракте, свойства пищеварительных пептидаз.
2. Освоить методы качественного и количественного анализа желудочного сока для оценки секреторной функции желудка здорового организма и возможных отклонений при патологии.
Вопросы для самоподготовки
1) Роль белков в организме.
2) Понятие «азотистый баланс» и возможные его изменения (равновесие, положительный и отрицательный азотистый баланс).
3) Нормы белка в питании. Биологическая ценность белков.
4) Переваривание белков в желудке. Роль соляной кислоты, гистамина.
5) Механизмы активации ферментов (пепсин, трипсин, химотрипсин).
6) Переваривание белков ферментами желудочно-кишечного тракта, специфичность действия, локализация эндо- и экзопептидаз, дипептидазы.
7) Всасывание аминокислот. Транспортеры.
8) Пути превращения невсосавшихся аминокислот под действием микрофлоры кишечника. Химизм (реакции) образования кадаверина и путресцина, сероводорода и других газов, крезола и фенола, скатола и индола при метаболизме аминокислот микрофлорой кишечника. Получение индикана, диагностическое значение.
9) Обезвреживание токсичных продуктов распада белков в печени. Этапы окисления и конъюгации с серной и глюкуроновой кислотами. Роль ФАФС и УДФ-ГК.
10) Характерные нарушения при длительном белковом голодании и болезни "квашиоркор".
Самостоятельная работа
Заполнить таблицу протеолитических ферментов желудочно-кишечного тракта (пепсин, трипсин, химотрипсин, эластаза, карбоксипептидаза, аминопептидаза):
| Фермент | Место действия | Оптимум рН | Субстратная специфичность |
Лабораторная работа 1.
Идентификация гистамина солями кобальта
Гистамин играет важную роль в регуляции переваривания белка в желудке. Нейрогуморальная регуляция сокоотделения осуществляется при нахождении пищи в желудке, когда секреция желудочного сока стимулируется за счет вагуса, метасимпатической нервной системы, гастрина, гистамина и питательных веществ (белки, пептиды, аминокислоты). Гистамин является одним из сильнейших стимуляторов желудочной секреции и, в зависимости от дозы, вызывает субмаксимальную и максимальную гистаминовую секрецию. Гистамин в этом качестве используют в медицинской практике при обследовании пациентов гастроэнтерологического профиля (зондирование).
Принцип
Гистамин реагирует с солями кобальта с образованием окрашенных в красно-фиолетовый цвет комплексных солей.
Реактивы
1) Навеска гистамина (0,01‑0,02 г), 2) раствор кобальта нитрата или кобальта хлорида, 3) раствор натрия гидроксида.
Проведение анализа
Навеску гистамина растворить в 1,0 мл воды, добавить 2‑3 капли раствора кобальта нитрата или кобальта хлорида и каплю раствора натрия гидроксида. Выпадает осадок красно-фиолетового цвета.
Оформление работы
Указывают принцип метода, регистрируют результаты, делают вывод о наличии гистамина. Поясняют роль гистамина в желудочной секреции.
Лабораторная работа 2.
Обнаружение свободной соляной кислоты
в желудочном соке при помощи индикаторов
Отклонения в составе пищеварительных соков или появление в них компонентов, не содержащихся в физиологических условиях, дает важную информацию о патологии пищеварения. В клинической практике методы анализа желудочного сока используют для диагностики и лечения заболеваний. При анализе желудочного сока определяют его общее количество, цвет, запах, наличие слизи, общую кислотность, количество свободной и связанной соляной кислоты, присутствие молочной кислоты, крови и желчных пигментов.
Принцип
В присутствии свободной соляной кислоты в желудочном соке индикатор «конго красный» меняет окраску на синюю, оставаясь в нейтральной и щелочной среде красным (зона перехода рН 3,0‑5,2). Индикатор п‑диметиламиноазо-бензол (ПДААБ), в присутствии свободной HCl имеет красную окраску, в щелочной среде ‑ желтую (зона перехода рН 2,3‑4,2).
Реактивы
1) Индикаторная бумага «конго красный», 2) 0,5% спиртовой раствор индикатора п‑диметиламиноазобензола.
Материалы для исследования
Желудочный сок нормальный и патологический (с разной кислотностью).
Проведение анализа
1. На две разные полоски индикаторной бумаги «конго красный» наносят стеклянной палочкой по 1 капле желудочного сока (нормальный и патологический). 2. В две пробирки вносят по 10 капель исследуемого желудочного сока (нормальный и патологический), добавляют по 2 капли индикатора ПДААБ.
Практическое значение
Свободная соляная кислота способствует превращению пепсиногена в пепсин, денатурации пищевых белков, оказывает бактерицидное действие, создает оптимальную pH среды для воздействия пепсина, стимулирует выработку секретина, ускоряет всасывание ионов железа. При воспалительных процессах в желудке имеет место нарушение секреции соляной кислоты и, соответственно, переваривания белков.
Оформление работы
Указывают принцип метода, регистрируют результат в таблице, делают вывод о кислотности сока.
| Образец | Изменение окраски индикатора | Величина |
| |
| конго красный | ПДААБ | |||
| Нормальный | ||||
| Патологический | ||||
Лабораторная работа 3.
Определение общей кислотности, свободной и связанной
соляной кислоты в одной порции желудочного сока
В работе последовательно исследуются образцы нормального и трех типов патологического желудочного сока. Сначала необходимо провести качественные реакции на свободную HCl (лабораторная работа 1). Если в итоге бумага «конго» приобретает синюю, а диметиламиноазобензол оранжево‑красную окраску, то в одной порции желудочного сока определяют все виды кислотности, как описано ниже. Если бумага «конго» остается красной, а диметиламиноазобензол окрашивает содержимое колбы в желтый цвет, то в этом образце можно определить только общую кислотность в присутствии фенолфталеина.
Принцип
Метод основан на определении кислотных веществ желудочного сока путем их титрования раствором NaOH в присутствии двух индикаторов ‑ диметиламиноазобензола (интервал перехода рН 2,3‑4,2) и фенолфталеина (зона перехода рН 8,2‑10,0). По изменению окраски индикатора диметиламиноазобензола от красной к оранжевой определяется свободная соляная кислота, а по переходу окраски фенолфталеина (от бесцветной к розовой) ‑ общая кислотность.
Реактивы
1) 0,1 М раствор NaOH, 2) 1% спиртовой раствор фенолфталеина, 3) 0,5% спиртовой раствор пара‑диметиламиноазобензола.
Материалы для исследования
Образцы нормального и патологического (N 1, 2, 3) желудочного сока.
Проведение анализа
В коническую колбу помещают 5 мл исследуемого желудочного сока, добавляют по 2 капли диметиламиноазобензола и фенолфталеина. В присутствии свободной HCl наблюдается красное окрашивание, при её отсутствии ‑ желтое. Титруют 0,1 М раствором NaOH до появления оранжево‑красной окраски, отмечают объем (мл), пошедший на титрование свободной HCl ‑ 1 пункт титрования. Продолжают титрование до появления лимонно‑желтой окраски, снова отмечают объем щелочи, израсходованной с начала титрования ‑ 2 пункт титрования. Продолжают титрование до появления розовой окраски, отмечают объем щелочи, пошедший на все титрование ‑ 3 пункт титрования.
Все отсчеты делают от нулевой отметки.
Расчет
За единицу кислотности желудочного сока принимают: объем 0,1 М NaOH (мл), необходимый для нейтрализации кислых эквивалентов в 100 мл желудочного сока (титрационные единицы) или количество миллимолей HCl в 1 л сока. Численно эти величины совпадают (40 ТЕ = 40 ммоль/л).
Пример расчета.
На титрование 5 мл желудочного сока до первой отметки израсходовано 2,0 мл NaOH, до второй ‑ 2,22 мл, до третьей ‑ 3,18 мл.
а) Содержание свободной HCl будет равно:
(2 ´ 100) : 5 = 40 ммоль/л
б) Содержание общей HCl рассчитывают как среднее арифметическое между вторым и третьим пунктами титрования:
(2,22 + 3,18) : 2 ´ (100 : 5) = 40 ммоль/л
в) Содержание связанной HCl составит:
54 – 40 = 14 ммоль/л
г) Общая кислотность будет равна:
(3,18 ´ 100) : 5 = 63,6 ммоль/л
Нормальные величины
Свободная HCl ‑ 20‑40 ммоль/л;
связанная HСl ‑ 10‑20 ммоль/л;
общая кислотность 40‑60 ммоль/л.
Оформление работы
Указывают принцип метода, регистрируют результаты в виде таблицы, производят расчёты, делают вывод о наличии HCl в образцах.
| Образец | Количество 0,1 М NaOH, израсходованное | Соляная кислота, | Общая кислотность | ||||
| 1 пункт | 2 пункт | 3 пункт | своб. | общая | связ. | ||
| Нормальный | |||||||
| Патологический 1 | |||||||
| Патологический 2 | |||||||
| Патологический 3 | |||||||
Практическое з начение
Определение кислотности желудочного сока важно для диагностики ряда заболеваний желудка. При патологии кислотность может быть нулевой, повышенной, пониженной. Увеличение содержания свободной HСl и общей кислотности (гиперхлоргидрия) имеет место при гиперацидном гастрите, часто сопровождается язвенной болезнью желудка и двенадцатиперстной кишки. Пониженная кислотность (гипохлоргидрия) встречается при гипоацидном гастрите, иногда при язвенной болезни желудка. Ахлоргидрия (полное отсутствие соляной кислоты) и значительное снижение общей кислотности отмечается при хроническом гастрите и раке желудка. Отсутствие HСl и пепсина (ахилия) связаны со злокачественными новообразованиями желудка, злокачественным малокровием. Ахлоргидрия сопровождается появлением в желудке микроорганизмов и сопутствующих продуктов брожения ‑ молочной, масляной, уксусной кислот.
Лабораторная работа 4 (теоретически).
Беззондовый метод определения кислотности
желудочного сока (ацидотест)
Принцип
Введенный в желудок per os краситель (2,4‑диамино‑4‑этоксиазобензол) освобождается из драже под действием свободной HСl (pH<3,0). Через 1,5 часа краситель появляется в моче. При подкислении мочи кислотой (25 % раствор HСl) образуется солянокислая соль красителя красного цвета. Сопоставление окраски с приложенной шкалой служит показателем кислотности желудочного сока.
Реактивы
1) 25 % соляная кислота, 2) таблетки кофеинбензоата натрия, 3) драже красителя 2,4‑диамино‑4‑этоксиазобензола.
Материал для исследования
«Контрольная» моча и моча, собранная через 1,5 часа после приема красителя.
Проведение анализа
Подготовка пациента: после голодания в течение 8 часов и опорожнения мочевого пузыря пациент принимает кофеинбензоат натрия (в 100 мл воды), стимулирующего желудочную секрецию и диурез. Через 1 час собирают «контрольную» мочу. Пациент, не разжевывая, проглатывает драже красителя и через 1,5 часа собирает мочу. Анализируют одновременно обе порции мочи: доводят водой до 200 мл, отбирают по 5 мл разбавленной мочи, добавляют по 5 мл 25 % HCl и сравнивают со шкалой.
Практическое значение
Метод «ацидотест» удобен, надежен, щадит больного, рекомендуется при противопоказаниях к фракционному зондированию (гипертоническая болезнь, нейропатии), может применяться у детей, при необходимости скринингового обследования групп пациентов.
Оформление работы
Отмечают суть метода «ацидотест», показания к его применению в клинике, границы и области практического применения, указывают его преимущества и недостатки.
Лабораторная работа 5.
Обнаружение патологической кислотности желудочного сока
Молочная кислота является конечным продуктом гликолиза, протекающего в анаэробных условиях. При снижении кислотности желудочного сока (гипоацидный гастрит и др. заболевания со снижением синтеза НСl) снижаются его бактерицидные свойства, вследствие чего анаэробная микрофлора, попадающая из полости рта в желудок, оказывается в оптимальных условиях и активно нарабатывает лактат в процессе молочнокислого брожения углеводов.
Принцип
Метод основан на реакции Уффельмана: при взаимодействии с лактатом комплексное соединение фенолята железа (III) фиолетового цвета превращается в малодиссоциирующую соль лактата железа зеленовато‑желтого цвета.
Реактивы
1) 1 % раствор фенола, 2) 1 % раствор FeCl3, 3) 4 % раствор молочной кислоты.
Материал для исследования
Нормальный и патологический желудочный сок.
Проведение анализа
В пробирке готовят раствор фенолята железа из 2,0 мл раствора фенола и 3 капель раствора FeCl3, смесь разливают поровну в 3 пробирки. Затем в 1 пробирку добавляют 1-2 капли раствора лактата (контроль), во 2 ‑ нормальный желудочный сок, в 3 ‑ патологический. При наличии лактата фиолетовая окраска заменяется зеленовато-желтой, при его отсутствии жидкость обесцвечивается.
Практическое значение
Наличие патологической кислотности (продуктов брожения: молочной, уксусной, масляной кислот) в желудочном соке указывает на сдвиг показателя кислотности от нормы в сторону повышения рН и появление в желудке анаэробных микроорганизмов и продуктов их жизнедеятельности.
Оформление работы
Указывают принцип метода, регистрируют результаты в таблице, делают вывод о наличии/отсутствии лактата и активности анаэробной микрофлоры в образцах желудочного сока.
| Исследуемая проба | Результат | |
| Желудочный сок | Нормальный | |
| Патологический | ||
Лабораторная работа 6.
Обнаружение крови в желудочном соке
с помощью диагностических полосок "Гемофан"
Принцип
Зона индикации диагностических полосок «Гемофан» содержит стабилизированную органическую гидроперекись, кислотный буфер, хромоген. Гемоглобин обладает ферментативной пероксидазной активностью, поэтому, катализирует окисление хромогена гидроперекисью с образованием продуктов синего цвета. В присутствии свободного гемоглобина зона индикации окрашивается равномерно, интактные эритроциты образуют на белом фоне яркие синие точки.
Материал для исследования
Образцы нормального и патологического желудочного сока.
Проведение а нализа
В каждый образец желудочного сока погружают индикационную зону полоски, вынимают, через 30‑60 сек сравнивают с прилагаемой на этикетке цветной шкалой. По индикаторным зонам шкалы, соответствующим цвету изучаемых образцов, определяют содержание гемоглобина/эритроцитов.
| Обозначения на шкале сравнения | Концентрация гемоглобина, г/л | Количество эритроцитов, ´106/л |
| 1 2 3 4 | 15‑45 45‑150 150‑240 ³300 | 5‑15 15‑50 50‑80 ³100 |
Практическое значение
Кровь (кровяные пигменты) может попадать в сок при изъязвлении стенок желудка. Желчные пигменты забрасываются в желудок из двенадцатиперстной кишки вследствие антиперистальтики.
Оформление работы
Указывают принцип метода, регистрируют результаты анализа, делают вывод о наличии крови в образцах желудочного сока, возможных причинах её появления и вероятных последствиях желудочных кровотечений.
Вопросы для самоконтроля
1) Азотистый баланс и его нарушения. Биоценность белков пищи, нормы белка в питании. Последствия недостаточности и избытка белка в питании.
2) Состав желудочного сока, роль отдельных компонентов ‑ соляной кислоты, ферментов, муцинов. Переваривание белков в желудке у взрослых и детей.
3) Пути активации и специфичность действия протеолитических ферментов желудочно-кишечного тракта. Полостное и пристеночное пищеварение. Эндо- и экзопептидазы, локализация в пищеварительном тракте. Всасывание аминокислот, транспортеры.
4) Метаболизм аминокислот под действием ферментов бактерий толстого кишечника с образованием газов, трупных ядов и других токсичных продуктов распада.
5) Нейтрализация в печени токсичных продуктов распада аминокислот с участием УДФ-ГК и ФАФС.
ТЕМА 6.2.
Общие и частные пути метаболизма аминокислот
Актуальность
Обмен белков выполняет ряд свойственных живой материи уникальных функций, поддерживая динамичное состояние между организмом и внешней средой. Свыше 20 природных аминокислот, часть из которых незаменимые, включаются в реакции общих и специфических путей превращения, что объясняет разнообразие и разветвленность метаболизма аминокислот. В медицине описаны многочисленные случаи нарушения различных этапов обмена аминокислот. Помимо превращений, свойственных всем аминокислотам, имеются последовательности реакций, характерные для каждой аминокислоты. Образовавшиеся продукты реакций могут играть важную, а иногда и решающую роль в процессах обмена веществ и определять физиологическое состояние организма. Известно более ста болезней, обусловленных наследственными дефектами обмена аминокислот. Аминокислоты и их производные широко применяются в клинической практике в качестве лекарственных препаратов.
Цель
1) Ознакомиться с главными путями превращений аминокислот и транспортной системой их проникновения через клеточные мембраны.
2) Изучить механизмы основных реакций внутриклеточного обмена аминокислот (дезаминирование, декарбоксилирование, трансаминирование) и ознакомиться с методом оценки активности аминотрансфераз в сыворотке крови.
3) Изучить направления основных путей превращений отдельных аминокислот, проявления патологии азотистого обмена. Ознакомиться с экспресс‑методом диагностики фенилкетонурии.
4) Освоить разделение аминокислот хроматографическим методом.
Вопросы для самоподготовки
1) Основные пути восполнения аминокислот в тканях.
2) Система транспорта аминокислот через клеточные мембраны.
3) Механизм реакций дезаминирования аминокислот. Окислительное дезаминирование. Оксидазы аминокислот. Анаэробная дегидрогеназа глутаминовой кислоты. Строение коферментов.
4) Значение реакций переаминирования. Механизм реакций трансаминирования. Строение аминотрансфераз, коферменты. Клинико-диагностическое значение ферментов трансаминирования – АсАТ и АлАТ.
5) Реакции декарбоксилирования. Строение ферментов, механизм реакций с участием пиридоксалевых коферментов, продукты.
6) Получение биогенных аминов, роль в организме. Дальнейшие пути превращения аминов, реакции нейтрализации и участие флавиновых коферментов.
7) Анаболические процессы, в которых участвуют аминокислоты.
8) Знакомство со специфическими путями обмена протеиногенных аминокислот (глицина, серина, метионина, цистеина, фенилаланина, тирозина, триптофана, дикарбоновых аминокислот), патологии при нарушениях обмена.
Дата добавления: 2020-04-25; просмотров: 206; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
