Гидриды редкоземельных металлов
Химические свойства гидридов РЗМ
Свойства вещества обуславливаются его электронным строением, свойства же гидридов — спецификой их строения. Достаточно подробно физико-химические свойства гидридов индивидуальных РЗМ и механизмы их образования рассмотрены в обзорах [99,138].
Характерной особенностью редкоземельных элементов является их электронная структура: внутренняя 4f-оболочка заполняется раньше, чем 5d-оболочки. Идеальная структура 5d6s2 не сохраняется, а наблюдается тенденция перехода 5d-электронов на 4f-уровень. Однако различие в энергиях невелико и поэтому редкоземельные элементы обладают, по существу, одинаковой электронной структурой и легко образуют трехвалентные ионы.
Все РЗМ образуют дигидриды, кроме европия и иттербия, которые имеют структуру, подобную флюориту. Дигидрид способен поглотить дополнительное количество водорода, с образованием тригидрида.
Между гидридами легких и тяжёлых РЗ-металлов существует различие. Так, дигидриды легких металлов, превращаясь в тригидрид, постепенно заполняют октаэдрические пустоты решетки флюорита атомами водорода. А дигидриды тяжелых металлов перестраивают структуру в гексагональную. Это различие отражено в фазовых диаграммах систем "легкий РЗМ - водород" и, аналогично, для тяжёлых РЗМ. Структура типа флюорита представляет собой гранецентрированную кубическую решетку с четырьмя атомами металла в положениях (0 0 0), (0 1/ 2 1/2), (1/2 0 1/2), (1/2 1/2 0) и восемью атомами водорода в тетраэдрических положениях. Повышение содержания водорода более двух атомов на атом металла приводит к уменьшению периода решетки (таблица 5). Сжатие начинается с содержания водорода более МН1,8. Это означает, что октаэдрические пустоты начинают заполняться до заполнения всех тетраэдрических пустот решетки. Стехиометрические тригидриды легких РЗМ образуются после заполнения всех октаэдрических пустот.
|
|
|
Таблица 5 - Кристаллическая решетка и периоды решетки гидридов РЗМ
| Металл | Дигидрид | Тригидрид | ||
| Структура | Период, А0 | Структура | Период, А0 | |
| Pr | Г.ц.к. | 5,518 | Г.ц.к. | 5,483 |
| Nd | Г.ц.к. | 5,464 | Г.ц.к. | 5,435 |
| Sm | Г.ц.к. | 5,374 | Г.п.у. | 3,782 С=6,779 |
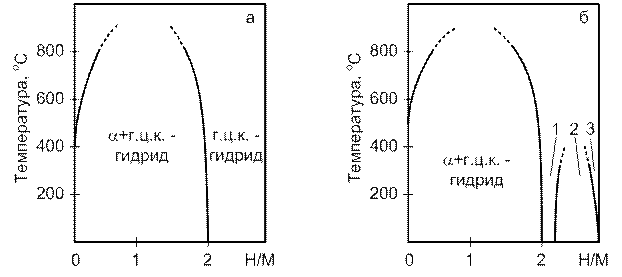
1- гранецентрированная кубическая; 2- смесь гранецентрированной кубической и гексагональной; 3 – гексагональная структура
Рисунок 10 – Обобщенные фазовые диаграммы системы РЗМ – водород для легкой группы РЗМ (а) и тяжелой (б)
Зависимость параметров г.ц.к. решётки от содержания водорода представлена на рисунке 10.
В работе [100] предполагается, что природа связи у дигидридов легких РЗМ преимущественно металлическая, а связь между металлом и водородом, находящимся в октаэдрических пустотах, преимущественно ионная. В источниках [134,135] было установлено, что при содержании водорода более МН2 тенденция к магнитному упорядочению подавляется (рисунок 11).
|
|
|
 |
Рисунок 11 - Зависимость параметров решетки от содержания водорода в гидриде
В [134] авторы объясняют это устранением электронов проводимости, вследствие образования анионов водорода. На основании значений теплот адсорбции водорода в источнике [136] предполагается, что связь первых двух атомов водорода с атомом РЗМ будет носить ковалентный характер (энергия 167-205 кДж/моль), а третьего ионный (41-82 кДж/моль).
В [137] приведены результаты исследования сравнительной устойчивости дигидридов РЗМ по давлению диссоциации и вычислены стандартные свободные энергии образования этих гидридов в зависимости от температуры (рисунок 12) и параметров кристаллической решетки при постоянной температуре (рисунок 13).
 |
Рисунок 12 - Стандартные энергии Гиббса некоторых дигидридов РЗМ
 |
Рисунок 13 – Зависимость свободной энергии от параметров кристаллической решётки при температуре 1100 К
Способностью к самовозгоранию обладает тот гидрид, который способен реагировать с кислородом, интенсивно выделяя тепло. Скорость выделения теплоты зависит от величины отношения площади поверхности к единице массы вещества (от этого зависит количество энергии, выделяющееся с единицы объёма). Также следует учитывать такие параметры окружающей среды как влажность, давление и температуру воздуха, нахождение поблизости реакционноспособных веществ и ряда других.
|
|
|
Как показывает практика, пирофорные свойства гидридов и соответствующих им металлов сходны между собой. Так, гидриды, находящиеся в высокодисперсном состоянии, склонны к самовозгоранию порой при температуре, близкой к комнатной. После нагревания гидридов, происходит выделение водорода, реагирующего с кислородом окружающей среды.
Не всегда происходит возгорание порошка при большом тепловыделении во время окислении. Случается и отсутствие взрывного характера, несмотря на интенсивное тепловыделение. На характер окисления оказывают влияние свойства оксидных плёнок, образующихся как результат окисления поверхностного слоя. Иногда такие порошки образуют аэрозоли, очень склонных к взрывному характеру протекания реакции окисления.
|
|
|
Термическая стабильность и устойчивость к возгоранию гидридов редкоземельных элементов обычно растёт с увеличением атомного номера.
Как правило, компактные гидриды очень стабильны к окислению и не возгораются на воздухе при нормальной температуре. Гидриды гадолиния, диспрозия и эрбия не пирофорны даже в высокодисперсном состоянии их порошков. Гидриды тербия, гольмия, тулия, иттербия и лютеция подробно не изучены, однако есть предположение относительно степени их пирофорности; предполагают, что они либо не пирофорны, либо если же и пирофорны, то незначительно.
Анализируя вышесказанное следует учитывать, что при работе с пирофорными гидридами необходимо предварительно удалить из них кислород и влагу из-за возможности взаимодействия.
Свойства гидридов неодима
Диаграмма состояния системы Nd-H представлена на рисунке 14.
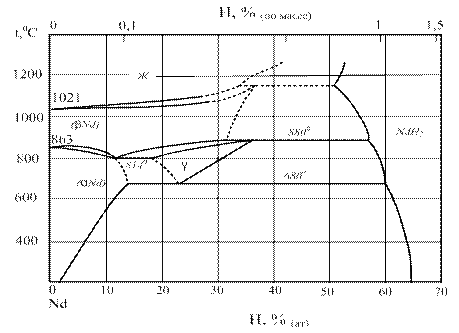
Рисунок 14 – Диаграмма состояния системы Nd-H [126]
Ранние работы [49, 50, 53] по системе Nd—Н показали, что система очень похожа на системы лантан; церий; празеодим — водород. Рентгенографическими исследованиями [51] было установлено, что нижний предел состава дигидридной фазы составляет NdH1,91.
На рисунке 15 представлена зависимость скорости поглощения водорода неодимом при различных значениях давления и температуры.
Давление диссоциации и термодинамические свойства. Изотермы состав — давление [103,104] изображены на рисунках 16,17. Две изотермы Корста и Уорфа получены на двух различных образцах. Наблюдается хорошее соответствие между данными для изобарной области (рисунок 16) и плохое — для области однофазного гидрида (рисунок 17).

Рисунок 15 - Скорость поглощения водорода неодимом при давлении 680 мм.рт.ст. и температуре 302 К
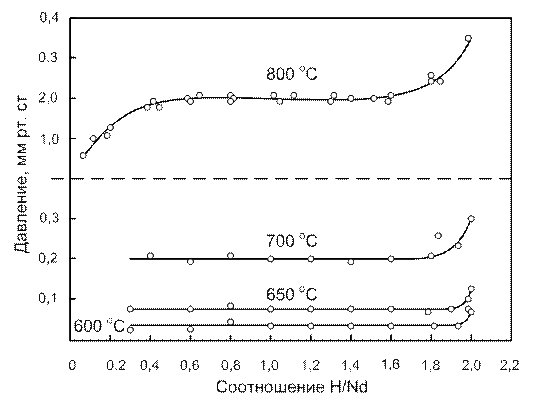
Рисунок 16 – Изотермы диссоциации гидрида неодима в области Nd-NdH2
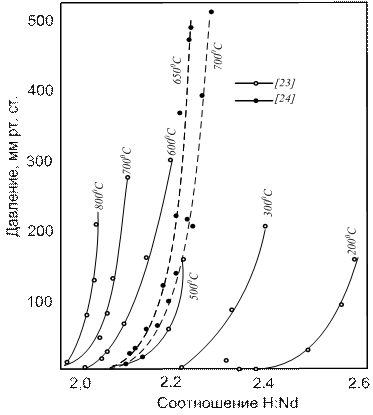
Рисунок 17 – Изотермы диссоциации гидрида неодима в области NdH2-NdH3
В [137] приведены следующие уравнения давления водорода при диссоциации гидридов неодима в изобарной области:
lgpH = (10,482 ± 0,28) — (11 031 ± 28)/Т; (1)
lgpH = (9,370 ± 0,179) — (9796 + 171)/Т. (2)
Теплоты образования, вычисленные из этих уравнений, равны 211,0 и 187,3 кДж/моль Н2 соответственно.
Структура и периоды решетки.
Периоды решеток для соединений NdH2 и NdH3 равны 5,463 и 5,419 Å соответственно [137].
Плотность. Рентгеновские значения плотности NdH2 и NdH3, приведенные в [137], равны 5,96 и 6,14 г/см3 соответственно.
Гидролиз гидрида неодима протекает экзотермически, однако тепла недостаточно, чтобы выделяющийся водород мог воспламениться. При комнатной температуре образуется гидрооксид неодима:
NdН2 + 2Н2О = Nd (ОН)2 + 2Н2. (3)
При температуре около 400°С реакция в присутствии паров воды, по-видимому, идет с образованием оксида неодима. Поэтому, при обычной температуре на воздухе мелкодисперсный гидрид неодима самовозгораться не должен. Это свойство, что очень важно, и может использовано на практике при получении и хранении порошков в технологии ТФЛ.
Методы получения гидридов
Наиболее важный и широко используемый метод получения гидридов состоит в прямом взаимодействии чистого водорода с чистым металлом. Каждой конкретной системе металл-водород свойственна своя оптимальная температура процесса. При таком взаимодействии металла с водородом сводятся к минимуму нежелательные побочные реакции. Этот метод технологичен и может быть использован для получения гидридов в больших количествах, а также для гидрирования металлических заготовок сложной формы. Конечно, иногда требуется получить гидрид с изменёнными механическими характеристиками. В таком случае определяют необходимую для этого температуру и давление по изотермам давление-состав.
При прямом гидрировании необходимо учитывать не только температуру и давление, но и:
· наличие примесей в металле;
· состояние поверхности металла (оксидные и нитридные плёнки и т.д.);
· чистоту водорода;
· состояние гидрируемого металла (порошок, куски, расплав, массивные детали и т.д.);
· предварительную и последующую термообработку.
Гидрид можно получить взаимодействием соответствующего оксида с металлом-восстановителем, например магнием, в присутствии водорода или взаимодействием оксида с гидридом металла. Этот приём иногда относят к прямым методам гидрирования. Однако таким методом не всегда удаётся получить очищенные от примесей и химически стабильные гидриды. Обычно этот метод уступает прямому методу получения гидридов высокой чистоты.
Существуют косвенные методы получения гидридов. Они используются в случаях неприменимости прямых методов гидрирования. К наиболее важным из косвенных методов можно отнести следующие [119-121]:
- пиролиз металлорганических соединений;
- реакции замещения между галлоидными соединениями металлов и гидридами активных металлов;
- реакции между галлоидными соединениями металлов реактивом Гриньяра в присутствии водорода;
- реакции между металлами и кислотами.
Дата добавления: 2020-01-07; просмотров: 733; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
